Муравьиная кислота Acidum formicum НСООН – жидкость с резким запахом. Соли и сложные эфиры муравьиной кислоты называются формиатами. Она обладает многими химическими свойствами карбоновых кислот, но ей присущи и некоторые специфические свойства.
Муравьиная кислота, в отличие от других карбоновых кислот, проявляет восстановительные свойства при взаимодействии с реактивом Толленса:
H-COOH + 2 │Ag(NH3)2 │OH→ HOCOOH + 2 Ag↓ + 4 NH3 ↑ +H2O
Наблюдаем выделение металлического серебра на стенках пробирки.
При нагревании с концентрированной серной кислотой муравьиная кислота дегидратируется с образованием оксида углерода (II):
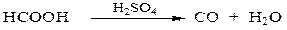
Применяется только наружно в виде спиртового раствора "муравьиный спирт" - как раздражающее средство при невралгиях, миозитах и т.п.
Уксусная кислота Acidum aceticum CH3COOH
Бесцветная жидкость с резким запахом. Безводная кислота в твердом состоянии похожа на лед - ледяная уксусная кислота.
Качественная реакция- с хлоридом железа(III)
CH3COOH +NaOH → CH3COONa + H2O
CH3COONa + FeCl3 → (CH3COO)3Fe + 3NaCl.
Образующийся ацетат железа имеет красно-бурое окрашивание.
Применяется как консервант и приправа. В химической промышленности - для синтеза фармпрепаратов. Многие соли (ацетаты), амиды, эфиры уксусной кислоты используются как лекарственные препараты.
Парацетамол и фенацетин являются замещенными амидами уксусной кислоты, уже много лет используются в медицинской практике
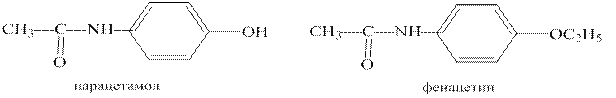
Акриловая кислота CH2 = CHCOOH – простейшая ненасышенная алифатическая карбоновая кислота. Соли и эфиры её называются акрилатами.
Акриловая кислота – типичный представитель α, β-ненасыщенных кислот, связь С = С в молекулах которых находится в сопряжении с карбонильной группой. Вследствие электроноакцепторного действия карбоксильной группы реакции электрофильного присоединения к двойной связи акриловой кислоты протекают против правила Марковникова:
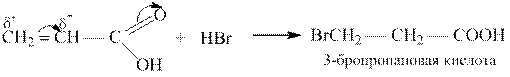
Применение: продукты полимеризации акриловой кислоты - полиакрилаты широко используются в стоматологической практике для изготовления протезов. Водные эмульсии полиакрилатов (типа латекса) применяются в производстве клеев и мягких медицинских пластырей.
Бензойная кислота Acidum benzoicum
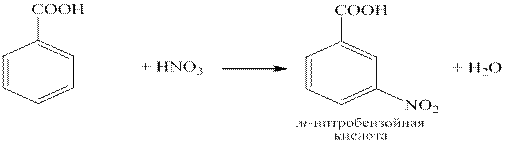
C6H5COOH – простейшая ароматическая карбоновая кислота. Соли и эфиры бензойной кислоты называются бензоатами. Бензойная кислота по химическим свойствам подобна карбоновым кислотам жирного ряда, но также ей присущи реакции электрофильного замещения. Так как карбоксильная группа является ориентантом второго ряда, электрофильное замещение у бензойной кислоты проходит в мета -положение:
Качественной реакцией для обнаружения бензойной кислоты и её солей служит образование желто-розового осадка основного бензоата железа (C6H5COO)3Fe·Fe(OH)3·7H2O↓, образующегося при взаимодействии в слабощелочной среде с хлоридом железа (III)
C6H5COOH + NaOH →C6H5COONa +H2O
6C6H5COONa + 2FeCl3 + 10 H2O → (C6H5COO)3Fe·Fe(OH)3·7H2O↓ +
3 C6H5COOH + 6 NaCl
Применяют - наружно как противогрибковое (фунгицидное) средство.
Щавелевая кислота HOOC ─ COOH – простейшая дикарбоновая кислота, широко распространена в растительном мире. В виде солей содержится в листьях щавеля, кислицы, ревеня. Малорастворимая в воде кальциевая соль является составной частью почечных камней. Щавелевая кислота – одна из самых сильных органических кислот, соли и эфиры её называются оксалатами.
Щавелевая кислота проявляет восстановительные свойства: в кислом растворе окисляется перманганатом калия в оксид углерода (IV). Эта реакция используется в аналитической химии для установления точной концентрации растворов перманганата калия. На восстановительных свойствах щавелевой кислоты основан способ удаления буро-коричневых пятен от перманганата калия.
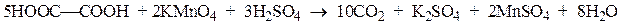
Качественной реакцией для обнаружения щавелевой кислоты и её солей служит образование малорастворимого оксалата кальция, осадок белого цвета.
H2C2O4 + CaCI2 → CaC2O4 ↓ + 2HCl
Изовалериановая кислота используется для получения таких лекарственных средств, как валидол и бромизовал. Этиловый эфир α-бромизовалериановой кислоты (СН3)2СНСН(Br)COOC2H5 входит в состав валокордина, корвалола и валосердина.
Высшие (жирные) карбоновые кислоты
Широко распространены высшие карбоновые кислоты, содержащие 16-18 атомов углерода и имеющие неразветвленную углеродную цепь.
Наиболее значимые: предельные - C15H31COOH пальмитиновая; C17H35COOH-
- стеариновая.
Непредельные - C17H33COOH -олеиновая
C17H31COOH- линолевая
C17H29COOH -линоленовая.
Применяется собственная номенклатура ненасыщенных жирных кислот. Концевой номер атом углерода обозначается последней буквой греческого алфавита ώ(омега). Нумерацию двойных связей ведут не как обычно от карбоксильной группы, а от концевой группы CH3. Линоленовую кислоту обозначают 18:3 ώ-3, где цифры через двоеточие обозначают общее число атомов углерода и число двойных связей.
Полиненасыщенные кислоты (линолевая и линоленовая) не синтезируются в организме, человек должен получать их с пищей. Для профилактики заболеваний, связанных с недостатком ненасыщенных кислот, применяют препарат «Линетол». Он представляет смесь этиловых эфиров кислот, получаемых из льняного масла. Важную роль в организме играет арахидоновая кислота, содержащая 20 атомов углерода и три двойных связи. Она является предшественником простагландинов – сильнодействующих биорегуляторов.
Натриевые и калиевые соли высших карбоновых жирных кислот (стеарат и пальмитат натрия, калия) называются мылами.
Вопросы для самостоятельного решения:
23. Напишите уравнения реакций, с помощью которых можно отличить соединения в каждой из приведенных пар:
а) муравьиная и уксусная кислоты;
б) кротоновая (бутен-2-овая) и масляная кислоты;
в) бензойная и щавелевая кислоты.
24.Некоторая двухосновная кислота образует нерастворимую в воде кальциевую соль, легко окисляется раствором перманганата калия до углекислого газа и воды, содержится во многих растениях. Напишите структурную формулу этой кислоты.
25. Некоторая карбоновая кислота взаимодействует с карбонатом натрия с выделением газа, вступает в реакцию нитрования, не обесцвечивает бромную воду, с раствором хлорида железа (III) в слабо щелочной среде образует осадок желто-розового цвета. Она содержится в клюкве, бруснике. Напишите структурную формулу этой кислоты и перечисленные уравнения реакций.
26. Основность некоторой карбоновой кислоты в два раза меньше числа атомов водорода в ее молекуле. При взаимодействии с концентрированной серной кислотой она выделяет оксид углерода (II), а также дает реакцию «серебряного зеркала». Напишите структурную формулу этой кислоты и перечисленные уравнения реакций.
 2020-10-11
2020-10-11 784
784








