Готовые окрашенные препараты рассматривают при помощи сложного оптического прибора — микроскопа. Микроскоп служит для изучения малых объектов, невидимых простым глазом. В микробиологии микроскопом пользуются для изучения как живых, так и убитых микробов в окрашенном или неокрашенном виде.
В микроскопе различают механическую и оптическую части.
Механическая часть микроскопа состоит из штатива, тубуса, предметного столика и системы винтов для настройки изображения: макрометрический винт и микрометрический, один поворот которого поднимает или опускает тубус на 0,1 мм. Микрометрический винт является одной из наиболее хрупких частей микроскопа, и обращение с ним требует особой осторожности.
Оптическая часть микроскопа состоит из окуляра, нескольких сменных объективов, закрепленных в револьвере, зеркала и конденсора с диафрагмой. Зеркало служит для отражения световых лучей по направлению к объективу и через него внутрь микроскопа. Одна из сторон зеркала плоская, другая вогнутая. Плоским зеркалом пользуются при дневном рассеянном свете, а вогнутым — при искусственном освещении.
Конденсор служит для конденсации пучка световых лучей, что обеспечивает наибольшее освещение исследуемого предмета. При микроскопировании с дневным светом конденсор необходимо поднять до уровня предметного столика; при искусственном освещении конденсор опускают до тех пор, пока при малом увеличении изображение источника света не появится в плоскости препарата. При микроскопировании неокрашенных препаратов конденсор следует также опустить.
Между зеркалом и конденсором помещается диафрагма, которая регулирует объем лучей, попадающих в объектив. Состоит диафрагма из стальных лепестков и при помощи рычага может суживаться или расширяться. Окрашенные препараты следует рассматривать при совершенно открытой диафрагме; при рассматривании же неокрашенных препаратов следует сузить отверстие диафрагмы. Объективы составляют наиболее ценную часть микроскопа. Они представляют собой систему двояковыпуклых линз, заключенных в металлическую оправу. Передняя (фронтальная) самая маленькая линза является главнейшей, производящей увеличение. Лежащие за ней линзы называются коррекционными, так как они предназначены для устранения недостатков оптического изображения.
Степень увеличения исследуемого объекта зависит от кривизны линзы объектива, которым мы пользуемся. Чем меньше кривизна линзы, тем меньше увеличение и, наоборот, — чем больше кривизна линзы, тем больше увеличение. Обычно объективы микроскопа имеют цифровое обозначение. В микроскопах старых систем объективы обозначались цифрами: 3, 7, 10,12. Это обозначение длины фокусного расстояния, которое зависит от кривизны линзы. В микроскопах новейших систем на оправе объективов обозначается даваемое ими увеличение: 8, 10, 20, 40, 60, 90. В микроскопах различают два типа объективов: сухие и иммерсионные, или погружные(immergo—погружаю). При исследовании микробов применяется исключительно иммерсионная или погружная система объективов. Эти объективыдают наибольшее увеличение по сравнению с другими объективами. Погружными их называют потому, что при работе с ним прибегают к погружению их в иммерсионную жидкость (кедровое масло). Обычно это делается так: каплю кедрового масла наносят на исследуемый объект, а затем при помощи макрометрического винта объектив погружают в эту капельку. Делается это для того, чтобы пространство между исследуемым объектом и объективом было заполнено кедровым маслом, которое конденсирует лучи, поступающие от препарата в объектив. Кедровое масло имеет примерно такой же коэффициент преломления световых лучей, как и стекло, и этим достигается наименьшее рассеивание световых лучей.
РИСУНОК 8
В отличие от иммерсионного объектива все другие объективы называются сухими, так как при работе они не погружаются в масло.
Окуляры (от слова oculus — глаз) имеют две линзы: верхняя линза называется глазной, нижняя — собирательной. Расстояние между линзами равно полусумме их фокусных расстояний. Следовательно, по длине окуляра можно приблизительно определить общее фокусное расстояние. А так как с уменьшением фокусного расстояния повышается увеличение окуляра, то более сильными будут короткие окуляры, более слабыми — длинные. В современных микроскопах на окулярах имеются цифры, указывающие на увеличение, которое они дают, например: Х7, Х10 Х15. Общее увеличение микроскопа равняется произведению увеличения объектива на увеличение окуляра. Так, например, комбинация иммерсионного объектива с показателем увеличения 90 и окуляром Х10 дает увеличение объекта в 900 раз.
Микроскопы, которыми мы обычно пользуемся, дают увеличение в 900—1000 раз. При пользовании такими микроскопами пределом видимости являются объекты размером не меньше 0,2 m.
Лаборант в своей практической работе должен помнить, что иммерсионный объектив требует особо бережного обращения с ним. Опускать этот объектив нужно осторожно, чтобы не раздавить стекла препарата, что влечет за собой порчу фронтальной линзы. Погружать иммерсионный объектив в каплю масла на предметном стекле надо под контролем глаза, наблюдая за этим сбоку, причем глаз должен находиться на уровне предметного столика. После погружения объектива в каплю масла, глядя в окуляр и пользуясь макрометрическим винтом, осторожно опускают тубус микроскопа еще ниже — до тех пор, пока не находят в поле зрения контуры препарата. Тогда оставляют в покое макрометрический винт и с помощью микрометрического винта устанавливают точное изображение объекта.
По окончании микрокопирования сначала поднимают тубус микроскопа, а затем снимают со столика препарат; фронтальную линзу осторожно вытирают мягкой тряпочкой, иногда смачивая ее бензином. Необходимо помнить что иммерсионная жидкость на воздухе образует трудно растворимую пленку, которая может вывести из строя дорогой оптический прибор – иммерсионный объектив.
ПРИЛОЖЕНИЕ 4.
Приготовление разведений. Чтобы получить изолированные колонии, культуру или материал, содержащий микроорганизмы, как правило, разводят. Обычно разведения проводят в стерильной водопроводной воде, пользуясь некоторым постоянным коэффициентом разведения, чаще всего равным 10. Таким образом, получают серию разведений, в которых концентрации клеток образуют геометрическую прогрессию. В ходе одного опыта целесообразно использовать один и тот же коэффициент разведения, так как в этом случае при большом числе подсчетов уменьшается вероятность ошибки. Для приготовления разведении стерильную водопроводную воду разливают по 9 мл в стерильные сухие пробирки. Затем 1 мл исходной суспензии, взятый стерильной пипеткой, переносят в пробирку с 9 мл стерильной воды—это 1-е разведение, 1: 10. Полученную в 1-м разведении суспензию с помощью новой стерильной пипетки тщательно перемешивают, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3—5 раз, что обеспечивает перемешивание суспензии и уменьшает адсорбцию клеток на стенках пипетки. Затем этой же пипеткой берут 1 мл полученного разведения и переносят его во 2-ю пробирку—это 2-е разведение, 1: 100. Таким же образом готовят и последующие разведения. Если используется другой коэффициент разведения, например, 3, тогда 1-е разведение будет 1: 3, 2-е— 1: 9, 3-е—1: 27 и т. д. Степень разведения определяется плотностью исходной суспензии микроорганизмов и соответственно число разведении тем больше, чем больше плотность исходной суспензии. Для приготовления каждого разведения следует обязательно использовать отдельную пипетку. Пренебрежение этой предосторожностью может привести к получению ошибочного результата, иногда в 100 и более раз превышающего истинный. Ошибка связана с адсорбцией микроорганизмов на стенках пипетки, в результате чего не все клетки удаляются из пипетки при каждом разведении. Часть клеток, оставшаяся на стенках пипетки, может затем попасть в одно из последующих разведении, что и явится причиной получения завышенного результата.
Посев в чашки. Высевать суспензию можно поверхностным или глубинным способом. Перед посевом суспензии поверхностным способом (рис.) в стерильные чашки Петри разливают расплавленную плотную, чаще всего агаризованную, питательную среду. Среду обычно разливают из большой колбы последовательно в ряд чашек Петри по 15—20 мл в каждую, и чашки оставляют на горизонтальной поверхности, пока агаризованная среда не застынет. Поверхность агаровых сред рекомендуется подсушивать, чтобы образующиеся колонии не расплывались по поверхности агара. Для этого чашки с застывшей средой помещают открытыми в сушильный шкаф, нагретый до 70—80°С. Шкаф предварительно необходимо простерилизовать. Среду подсушивают до появления на ее поверхности муаровой пленки. При этом с крышек чашки Петри удаляется конденсационная вода. В некоторых случаях агаризованную среду подсушивают, помещая чашки в термостат на 2—3 суток крышками вниз. Когда среда готова, на ее поверхность стерильно пипеткой наносят строго определенный объем (0, 05—0, 2 мл ) cooтветствующего разведения.
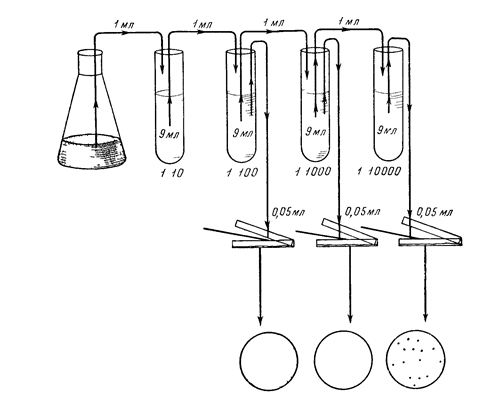
Этот объем распределяют стерильным стеклянным шпателем по поверхности агаризованной среды в первой чашке Петри.(Метод посева – "сплошной газон") Затем тем же шпателем проводят по поверхности плотной среды во 2-й и 3-й чашках Высевы па плотную среду производят обычно из трех последних разведении Из каждого разведения делают 2—4 параллельных высева Посевы из разведении можно делать одной пипеткой, но начинать следует обязательно с большего разведения Для каждого разведения используют новый стерильный шпатель Засеянные чашки Петри помещают в термостат крышками вниз

Выросшие колонии подсчитывают, определяя концентрацию клеток в определенном объеме того или иного разведения.
Трудно не заметить возможность использования этого метода и для выделения чистых культур микроорганизмов. Изолированные колонии – прекрасная возможность отсеять небольшое количество клеток на скошенный стерильный МПА.
ПРИЛОЖЕНИЕ 5
КРУГОВОРОТ УГЛЕРОДА И КИСЛОРОДА
Циклические превращения углерода и кислорода осуществляются главным образом в результате двух процессов— кислородного фотосинтеза, с одной стороны, и дыхания и горения — с другой. Именно путем кислородного фотосинтеза основная часть окисленной формы углерода (СО2) переходит в восстановленное состояние, в котором он находится в органических соединениях, а восстановленная форма кислорода (Н2О) окисляется до молекулярного кислорода (О2). Хотя другие автотрофы могут восстанавливать СО2 до органического вещества, окисляя соединения, отличные от воды (NH3, NО2–, H2, Fe2+ и восстановленные формы серы), вклад этих процессов в общую фиксацию СО2 незначителен.
Гетеротрофный метаболизм, прямо или косвенно сопряженный с восстановлением молекулярного кислорода, завершает этот цикл путем генерации основных пищевых субстратов для кислородного фотосинтеза: СО2 и H2O. Водоросли и растения, а также питающиеся ими животные вносят свой вклад в этот процесс за счет дыхательной активности. Однако основную массу органического вещества окисляют бактерии и грибы. Таким образом, циклические превращения углерода и кислорода облигатно связаны между собой посредством кислородного фотосинтеза, с одной стороны, и аэробного дыхания—с другой (рис. 22).
Воздух содержит приблизительно 0, 03% СО2 (по объему), причем эта концентрация поддерживается относительно постоянной в результате динамического равновесия между фотосинтезом и минерализацией
РИСУНОК 22
Рис. 22. Круговорот углерода и кислорода.
Окисление углерода и кислорода показано сплошными стрелками, восстановление — точечными, а реакции без изменения валентности — пунктирными стрелками
О важности углеродного цикла лучше всего говорит расчет, показывающий, что вся СО2 атмосферы в случае отсутствия ее пополнения была бы полностью исчерпана при современной скорости фотосинтеза менее чем за 20 лет. Этот вывод не покажется преувеличением, если представить себе, что углерод, содержащийся в отдельном экземпляре гигантской секвойи, эквивалентен его количеству, присутствующему в атмосфере над площадью свыше 16 гектаров. На суше семенные растения являются основными организмами, проявляющими фотосинтетическую активность. Водоросли вносят здесь лишь небольшой вклад в фотосинтез. Однако в океанах именно одноклеточные фотосинтезирующие организмы играют наиболее важную роль в фотосинтезе. Микроскопические водоросли океана (называемые фитопланктоном) благодаря свободному плаванию способны развиваться в поверхностных слоях воды повсюду, где для них создаются благоприятные условия. Их рост ограничивается в основном относительной нехваткой двух элементов: фосфора и азота. Там, где эти элементы в виде фосфатов и нитратов поступают с дождевой водой с континентов, а затем распределяются в поверхностных слоях воды океаническими течениями, наблюдается обильное развитие фитопланктона Согласно одному из расчетов, общая ежегодная фиксация углерода в океанах достигает приблизительно 1, 2 х 1010 т, тогда как фиксация на суше составляет около 1, 6 х 1010т.
Хотя кислородный фотосинтез, несомненно, является наиболее важным способом восстановления CO2 до органического вещества, определенную, хотя и небольшую, роль в этом играют и другие процессы. Это фотосинтез, осуществляемый пурпурными и зелеными бактериями, восстановление СО2 хемоавтотрофами и гетеротрофная фиксация следовых количеств СО2 в ходе метаболизма большинством организмов.
ИЗЪЯТИЕ УГЛЕРОДА ИЗ КРУГОВОРОТА.
Неорганические отложения. Карбонатные ионы, содержащиеся в морской воде, соединяются с растворенными в ней ионами кальция и осаждаются в виде карбоната кальция. Последний откладывается также биологическим путем в известковых структурах простейших, кораллов и моллюсков. Таково происхождение известняковой горной породы (известняка), представляющей собой важный компонент поверхности материков. Карбонат кальция недоступен в качестве прямого источника углерода для фотосинтезирующих организмов, и поэтому образование известняков приводит к истощению общего запаса углерода, доступного для жизни. Тем не менее значительная часть этого углерода в конечном счете возвращается в круговорот благодаря выветриванию горных пород. Микроорганизмы играют важную роль как в растворении известняковых отложений на суше, так и в растворении фосфатов за счет образования кислоты в процессах денитрификации, окисления серы и брожения.
Органические отложения. Высокая влажность, вызывающая недостаток кислорода и накопление кислых веществ, иногда особенно благоприятствует накоплению гумуса. Это явление наиболее выражено в торфяных болотах, где с течением времени образуются отложения неполностью разрушенного органического вещества, называемые торфом. Эти отложения могут распространяться на десятки метров в глубь болота. Под влиянием сжатия, а также, вероятно, и других физических и химических факторов, действовавших в течение целой геологической эпохи, произошло превращение торфа в каменный уголь. Таким образом, в виде отложений торфа и каменного угля из биосферы изымается большое количество углерода.
Другой вид изъятия углерода в органической форме из круговорота представлен отложениями природной нефти и газа (метана).
Со времени промышленной революции добыча человеком органических соединений углерода из земных недр привела к весьма быстрой их минерализации. Хотя значительные запасы еще подлежат разработке, подсчитано, что при современных скоростях потребления большая часть нефти и природного газа будет израсходована за несколько десятилетий.
ПРОЦЕССЫ МИНЕРАЛИЗАЦИИ. ОБРАЗОВАНИЕ ДВУОКИСИ УГЛЕРОДА И ВОССТАНОВЛЕНИЕ КИСЛОРОДА
Биологическое превращение органического углерода в СО2 сопровождающееся восстановлением молекулярного кислорода, требует совместной метаболической активности разнообразных микроорганизмов. Сложные составные части мертвых клеток должны быть переварены, а продукты переваривания должны быть окислены специализированными организмами, которые могут использовать их в качестве пищевых веществ. Многие аэробные бактерии (псевдомонады, бациллы, актиномицеты), а также грибы осуществляют полное окисление органических веществ, образовавшихся из мертвых клеток. Однако следует помнить, что даже те организмы, которые образуют CO2 в качестве единственного продукта, выделяющегося при расщеплении органических соединений в процессе дыхания, обычно используют значительную часть субстрата для синтеза вещества собственных клеток. В анаэробных условиях органические соединения первоначально расщепляются путем сбраживания, а органические конечные продукты брожения окисляются далее в результате анаэробного дыхания, если имеются подходящие неорганические акцепторы водорода (нитрат, сульфат или CO2).
 2020-10-11
2020-10-11 212
212







