Пусть в цепь электрического тока включен сосуд с раствором какого-либо электролита, например HCl. Тогда произойдет явление, называемое электролизом (см. рис.1). Вследствие работы источника тока электроны с одного электрода (анода) будут "выкачиваться", а на другой (катод) - "накачиваться". Поэтому на аноде создается недостаток электронов, а на катоде - их избыток. Находящиеся в растворе ионы Cl- отталкиваются отрицательным электродом и притягиваются к положительному, а ионы H+ - наоборот.
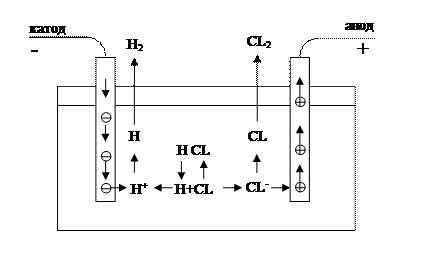
Рис.1
Таким образом, первые будут двигаться к аноду, вторые - к катоду. В связи с этим отрицательно заряженные ионы называют анионами (движущимися к аноду), а положительно заряженные - катионами (движущимися к катоду). При подходе к аноду ионов Cl- от них отнимается по одному электрону и они превращаются в нейтральные атомы. Два таких атома соединяются затем в молекулу и выделяются в виде газообразного хлора. Одновременно катод (содержащий избыток электронов) отдает подошедшим ионам водорода H+ электроны и переводит их в нейтральные атомы. Два таких атома образуют молекулу и газообразный водород улетучивается из сосуда.
Таким образом, при пропускании электрического тока сквозь раствор или расплав электролита у электродов протекают следующие процессы:
а) у анода - превращение анионов в нейтральные атомы (или группы атомов) с отдачей электронов;
б) у катода - превращение катионов в нейтральные атомы (или группы атомов) с отдачей электронов.
И то и другое прекращается лишь тогда, когда израсходуется весь электролит. Таким образом, сущность процесса электролиза состоит в осуществлении химических реакций за счет электрического тока.
Если вместо раствора HCl взять, например раствор CuCl2, то процесс у анода останется тем же, тогда как на катоде будет выделяться уже не водород, а металлическая медь. На этом основан метод электролитического покрытия одного металла слоем другого (для никелирования, золочения, хромирования и т.д.).
Несколько иначе пойдет процесс, если электролиз CuCl2 проводить с медным анодом. Так как атомы меди теряют электроны легче, чем ионы хлора Cl-, в этом случае вместо выделения хлора будет происходить переход с анода в раствор ионов Cu2+. Электролиз сведется, следовательно, к растворению меди на аноде и ее выделению на катоде. Такой процесс позволяет путем электролиза производить очистку металлов.
Процессы электролиза расплавов и растворов различных веществ очень широко используются в промышленности для получения самых различных соединений: металлов, газов, солей. Электролиз используется и в аналитической химии, как один из самых мощных методов разделения анализируемых элементов.
В зависимости от химической активности того или иного элемента переход его из атомного в ионное состояние происходит с различной легкостью. Следовательно, и обратно - необходимые для перевода различных ионов в нейтральные атомы напряжения электрического тока должны быть различными. Например, сравнительная активность металлов очень хорошо иллюстрируется рядом напряжений. Последний в основных чертах имеет следующий вид:
.....K.....Ca.....Mg.....Zn.....Fe.....Sn.....H.....Cu.....Ag.....Au.....
Ниже приводятся важнейшие следствия из ряда напряжений:
1) Каждый металл способен вытеснять из солей все другие, расположенные в ряду напряжений правее него.
2) Все металлы, расположенные левее водорода, могут вытеснять его из кислот, расположенные правее - не вытесняют.
3) Чем дальше друг от друга расположены два металла, тем большее напряжение может давать построенный из них гальванический элемент.
Чем левее стоит в ряду напряжений металл, тем труднее выделить его из раствора при электролизе.
На различии напряжений, требующихся для осаждения отдельных металлов, основаны некоторые важные методы их разделения. Если, например, имеется раствор смеси солей Zn и Cu, то при соответствующем регулировании напряжения медь осядет на электроде, а цинк останется в растворе.
Итак, для перевода отдельных ионов в нейтральные атомы требуется различное напряжение тока, величина которого зависит от химической природы иона. Гораздо проще отношения, наблюдающиеся для затрачиваемого при электролизе количества электричества. Каждый однозарядный ион, независимо от его химической природы, получает или отдает при этом один электрон, двухзарядный - два и т.д. Следовательно, для разложения и выделения в элементарном состоянии одного грамм-иона любого одновалентного элемента нужно затратить одинаковое количество электричества, для грамм-иона двухвалентного - вдвое большее и т.д. Соотношение становится еще более общим если перейти к эквивалентным весам, так как в этом случае отпадают различия, связанные с зарядами ионов.
Законы электролитической проводимости были экспериментально установлены Фарадеем в 1836 году. Этих законов два.
Первый закон Фарадея относится к связи между количеством выделившегося на электроде вещества, силой тока и временем прохождения тока через электролит. Этот закон имеет следующий простой смысл: масса выделившегося на электроде вещества M пропорциональна силе тока I и времени его прохождения t:
M=kIt, (1)
где k - коэффициент пропорциональности, зависящий только от рода выделившегося вещества и состава электролита.
Произведение силы тока I на время t представляет собой количество электричества Q, прошедшее через электролит:
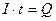 ,
,
откуда первому закону Фарадея можно придать вид:
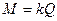 ,
,
т.е. масса выделившегося вещества M пропорциональна прошедшему через электролит количеству электричества Q. Коэффициент k называется электрохимическим эквивалентом выделяемого вещества.
При Q =1 численно имеем M = k, т.е. электрохимический эквивалент численно равен массе вещества, выделившегося при прохождении через электролит единицы количества электричества.
Второй закон Фарадея определяет величину электрохимического эквивалента k. Прежде чем формулировать второй закон Фарадея, напомним некоторые химические характеристики вещества.
Химическим эквивалентом элемента называется безразмерная величина, численно равная массе данного элемента, выраженной в граммах, которая замещает в химических соединениях 1,0078 г водорода.
Валентностью элемента называется число атомов водорода, которое замещается в химическом соединении одним атомом данного элемента. Обозначив через A атомный вес элемента, через n - его валентность, получим, что химический эквивалент равен A/n. Если взять A/n граммов элемента, то такое количество этого элемента составит грамм-эквивалент.
Второй закон Фарадея состоит в том, что электрохимические эквиваленты элементов k пропорциональны их химическим эквивалентам:
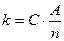 , (2)
, (2)
где C - коэффициент пропорциональности, одинаковый для всех элементов.
Обычно вместо коэффициента C вводят величину, ему обратную:
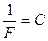 ,
,
тогда второй закон Фарадея принимает вид:
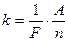 . (2а)
. (2а)
Величина F называется числом Фарадея. Подставляя значение электрохимического эквивалента k из (2а) в выражение для первого закона Фарадея (1), получим формулу, объединяющую оба закона Фарадея:
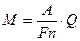 (3)
(3)
Отсюда следует, что если выделяется один грамм-эквивалент вещества, т.е. масса M, численно равная A/n, то Q должно численно равняться F.
Таким образом, число Фарадея F численно равно количеству электричества Q, при прохождении которого через электролит на электроде выделяется один грамм-эквивалент вещества.
Измерения электрохимических эквивалентов дают для числа Фарадея F следующее значение:
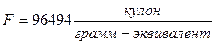
Особое значение законы Фарадея сыграли в установлении электронной теории. Из формулы (3) следует, что для выделения одного грамм-эквивалента любого вещества требуется прохождение через электролит вполне определенного количества электричества, численно равного числу Фарадея F. Количество атомов в грамм-эквиваленте N’ зависит от валентности элемента n и, очевидно, равно
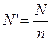 ,
,
где N - число Авогадро. Таким образом, выделение каждого атома связано с прохождением через электролит количества электричества
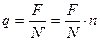 . (4)
. (4)
По ионной теории проводимости электролитов прохождение тока сводится к передвижению ионов, отсюда из формулы (4) вытекает, что ион каждого элемента несет заряд q, пропорциональный валентности элемента n.
Наименьший заряд иона e соответствует заряду одновалентного иона (n =1), откуда
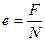 . (5)
. (5)
Так как валентность элемента выражается целым числом n, то заряд q переносимый любым ионом, 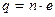 , оказывается целым кратным от наименьшего заряда e. Таким образом, закон Фарадея в совокупности с атомной теорией вещества приводит к представлению об атомном строении электричества. Этот вывод был сделан одновременно и независимо друг от друга Гельмгольцем и Стонеем в 1881 году. Каждый атом вещества может терять или присоединять к себе заряд, кратный элементарному заряду e. Очевидно, этот элементарный заряд e представляет собой заряд электрона. Положительный ион образуется, если атом или молекула теряет один или несколько электронов. Отрицательный ион образуется, если атом или молекула присоединяет к себе один или несколько электронов.
, оказывается целым кратным от наименьшего заряда e. Таким образом, закон Фарадея в совокупности с атомной теорией вещества приводит к представлению об атомном строении электричества. Этот вывод был сделан одновременно и независимо друг от друга Гельмгольцем и Стонеем в 1881 году. Каждый атом вещества может терять или присоединять к себе заряд, кратный элементарному заряду e. Очевидно, этот элементарный заряд e представляет собой заряд электрона. Положительный ион образуется, если атом или молекула теряет один или несколько электронов. Отрицательный ион образуется, если атом или молекула присоединяет к себе один или несколько электронов.
Соотношение (5) позволяет определить заряд электрона по числу Фарадея F и числу Авогадро N. Полагая, число Авогадро 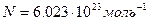 получим, что представляет собой ныне принимаемое значение заряда электрона.
получим, что представляет собой ныне принимаемое значение заряда электрона.
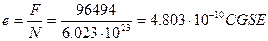 .
.
 2020-10-10
2020-10-10 143
143








