Уравнение Ван-дер-Ваальса уже является уравнением неидеального газа, в будущем будем именовать «реального» газа (МРГ). В неидеальных, т.е. реальных, газах в отличие от идеальных газов существенны силы межмолекулярных взаимодействий, силы притяжения, когда молекулы находятся на значительном расстоянии, и сила отталкивания при достаточном сближении их друг с другом, нельзя пренебречь собственным объемом молекул.
Уравнение Ван-дер-Ваальса:
(p + 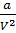 ) * (V-b) = RmT, где (1.1)
) * (V-b) = RmT, где (1.1)
Pмол = 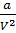 – давление (молекулярное), или внутреннее давление молекул газа, где
– давление (молекулярное), или внутреннее давление молекул газа, где
а – коэффициент пропорциональности, зависящий от природы газа
a = 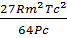
 b =
b = 
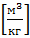
Tc, К – критическая температура, это такое значение температуры, при которой свойства газовой и жидкой фазы тождественны. Это критическая температура; постоянная справочная величина, соответствующая значению температуры и давления, при которых все свойства газовой и жидкой фазы становятся тождественны. Критическая температура Tc соответствует такому значению температуры, выше которой газ невозможно перевести в жидкое состояние, увеличивая давление.
Наличие межмолекулярных сил отталкивания приводит к тому, что молекулы могут сближаться между собой только до некоторого минимального расстояния. Поэтому можно считать, что свободный для движения молекул объем будет равен V-b, где b – тот минимальный объем, до которого можно сжать газ, 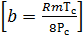 .
.
Поскольку длина свободного пробега молекул уменьшается, число ударов о стенку в единицу времени увеличивается, а, следовательно, и давление возрастает по сравнению с идеальным газом. Выражаем из уравнения (1.1) давление:
p = 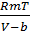 -
- 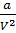
Вывод уравнения состояния Ван-дер-Ваальса в вириальном виде.
(P+a/V2)(V-b)=RmT – уравнение Ван-дер-Ваальса
Представим коэффициент сжимаемости газов (паров) Z в вириальном виде.
Z=1+ 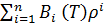 , где (1.2)
, где (1.2)
1 – коэффициент сжимаемости идеального газа;
B1 – второй вириальный коэффициент, учитывает парное столкновение молекул газа, 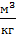 ;
;
В2 = С – третий вириальный коэффициент, учитывает тройное столкновение молекул газа, 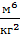 .
.
Ряд бесконечный, но для газов и паров сходящийся, поэтому применяется в усечённом виде (1.3).
Z=1+B*ρ (1.3)
Для жидкости ряд расходится и не может быть применим.
Коэффициент сжимаемости газов (паров) Z показывает отношение идеальногазовой плотности 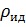 (модели Клапейрона-Менделеева) МИГ к плотности реального газа
(модели Клапейрона-Менделеева) МИГ к плотности реального газа 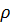 (МРГ). (1.4)
(МРГ). (1.4)
Z= 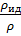 =
= 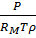 =
= 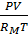 (1.4)
(1.4)
Представим вывод уравнения Ван-дер-Ваальса в вириальном виде и проанализируем полученный результат:
Z=1+B/V+C/V2, где ρ=1/V, т.е. ограничимся тремя вириальными коэффициентами, поскольку ряд сходится.
Выразим P из уравнения (1.1):
p = 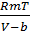 -
- 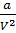
Z 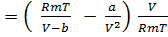 = V/(V-b)-a/VRmT
= V/(V-b)-a/VRmT
Z=V/(V-b)-a/VRmT
Выполним математические преобразования (1.5):
V/(V-b)=V*1/(V-b)=1+  +
+ 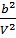 +
+ 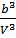 +….+=1+
+….+=1+  (1.5), ряд сходится
(1.5), ряд сходится
Получаем выражение в вириальном виде (1.6):
Z=1+(b-a/RmT)1/V+ b2/V2+b3/V3+…+= 1 +(b-a/RmT)1/V + 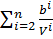 (1.6)
(1.6)
Из полученного выражения видно, что 1 – первый член ряда соответствует идеальному газу (МИГ), B = (b-a/RmT)1/V – второй вириальный коэффициент, С = b2/V2 – третий вириальный коэффициент. Единица представляет собой идеальногазовое состояние (абсолютную сжимаемость), последующие члены учитывают отклонение от модели идеального газа МИГ.
Недостаток уравнения Ван-дер-Ваальса: силы межмолекулярного взаимодействия учитываются только во втором вириальном коэффициенте. Этот факт сразу обнаруживает ограниченность этой модели: силам межмолекулярного взаимодействия априори ставиться второстепенная роль по сравнению с собственным объёмом молекул газа (пара).
При больших удельных объёмах и сравнительно невысоких давлениях уравнение Ван-дер-Ваальса практически вырождается в уравнение идеального газа Клапейрона-Менделеева Уравнение Ван-дер-Ваальса с качественной стороны достаточно хорошо описывает свойства неидеальных газов, но результаты численных расчетов не всегда согласуются с экспериментальными данными. В ряде случаев это объясняется склонностью молекул неидеального газа к ассоциации в комплексы, наглядным примером может служить молекулы водяного пара.
 2020-10-11
2020-10-11 1060
1060
