Аналитический аппарат равновесной термодинамики.
Объект и методы исследования. Постулаты о равновесии и транзитивности равновесия, следствия этих положений.
I-ый и II-ый законы равновесной термодинамики как постулаты существования внутренней энергии и энтропии – функций состояния макросистем. Теорема Нернста. Математические записи этих положений в общей форме для открытых и закрытых систем, их практические следствия. Понятие о превратимой (доступной) и балластной части внутренней энергии. Работа как безэнтропийная форма энергообмена.
Термодинамические функции и функционалы. Характеристики функции и их свойства. Структура дифференциальных уравнений для систем с двумя независимыми переменными. Основные задачи, решаемые методом равновесной термодинамики.
Семинар №1-2 Расчётное соотношение внутренней энергии неидеального газа и его вывод.
U(T,V) = Uид(T) + ΔUттеор [кДж/кмоль] (1.1)
где ΔUттеор – изотермическое отклонение, которое учитывает отклонение от идеальногазовой модели (МИГ)
Уравнение внутренней энергии идеального газа
Uид(T) = U˚(To) +  , (1.2)
, (1.2)
где To – точки отсчета внутренней энергии(стандартное состояние)
To = 273,15K
Внутренняя энергия идеального газа является функцией только температуры «Т» и не зависит от объёма, занимаемого газом (1.3).
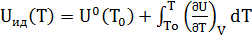 (1.3)
(1.3)
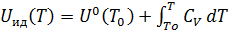 ,
,
где  – изохорная теплоёмкость идеального газа.
– изохорная теплоёмкость идеального газа.
Если газ является калорически совершенным, то теплоёмкость газа не зависит от температуры, а определяется числом степеней свободы газа:
 =
=  RmT, где j=
RmT, где j= 
Приведём пример:
j=3 для одноатомных газов (He, Ar);
j=5 для двухатомных одноимённых и разноимённых газов (N2, NO);
j=7 для трёх и более атомов, а также для смеси любых, в том числе одноатомных газов (классический пример воздух).
Реальные газы и их смеси учитывают зависимость внутренней энергии от объёма, ими занимаемого:
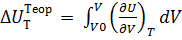 (1.4), где
(1.4), где
ΔUттеор – теоритическое изотермическое отклонение, которое учитывает отклонение от идеальногазовой модели (МИГ)
На основание объединённого уравнения 1-го и 2-го начала равновесной термодинамики,а также уравнения Максвелла(в качестве термодинамического потенциала выступает энергия А(V,T)
Гиббса-Гельмгольца (1.5).
TdS = dU + pdV (1.5)

Из уравнения Максвелла для изохорно-изотермического потенциала имеем: 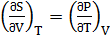 (1.6)
(1.6)
Подставим данное соотношение и получим (1.7):
 (1.7)
(1.7)
Из уравнения Ван-дер-Ваальса выведем:

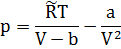
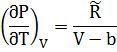
Откуда следует:


Подставим в уравнение (1.4) 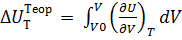 :
:


Т.к. 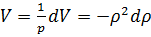
Таким образом уравнение внутренней энергии неидеального газа имеет вид:

 Полученное выражение позволяет сделать вывод о влияние на величину внутренней энергии объёма, занимаемого газом.
Полученное выражение позволяет сделать вывод о влияние на величину внутренней энергии объёма, занимаемого газом.
 2020-10-11
2020-10-11 146
146







