Термодинамика
Техническая термодинамика рассматривает закономерности взаимного превращения теплоты в работу. Она устанавливает взаимосвязь между тепловыми и механическими процессами, которые совершаются в тепловых машинах, к которым в общем случае относятся элементы пневмоавтоматики и пневмопривод.
Объектом изучения термодинамики является термодинамическая система - совокупность тел обменивающихся энергией между собой и внешней средой. В пневмоавтоматике таким объектом изучения является пневмосистема - техническая система, состоящая из устройств, находящихся в непосредственном контакте с рабочим телом. Рабочим телом называется промежуточное физическое тело, обеспечивающее передачу энергии. В нашем случае рабочим телом является сжатый газ различной природы. Свойства рабочего тела существенно влияют на свойства автоматической системы и привода в частности (Пример: гидропривод, электропривод). В связи с этм проектирование, описание и области примения отчетливо позволяют выделить в отдельные дисциплины электропривод (рабочее тело – электромагнитное поле), гидропривод (рабочее тело – сжатая жидкость) и пневмопривод (рабочее тело – сжатый газ). Физическое состояние тела вполне определяется набором некоторых физических величин. Для однородного тела состояние может быть определено тремя параметрами, в качестве которых в технической термодинамике принимаются: удельный объем v, давление p и температура T.
Основыне термодинамические параметры состояния зависят друг от друга и взаимно увязаны уравнением состояния
F(v,p,T) = 0.
Рассматривается равновесное состояние ТДС - такое, когда во всех точках объема все параметры одинаковы и неизменны во времени. Переход ТДС из одного равновесного состояния в другое называется термодинамическим процесом.
В технической термодинамике сжатый газ обычно принимается идеальным. Идеальный газ - газ подчиняющийся законам Бойля-Мариотта и Гей-Люссака. Другими словами это газ, у которого нет взаимодействия между молекулами и молекулы не занимают объема. Это, естественно, идеализация, но она достаточно широко применяется из-за существенного упрощения анализа технических систем.
Роберт БОЙЛЬ(25.I. 1627 - 30.XII. 1691)  Он родился 25 января 1627 года в Лисморе (Ирландия), а образование получил в Итонском колледже (1635-1638) и в Женевской академии (1639-1644). После этого почти безвыездно жил в своем имении в Столбридже, там и проводил свои химические исследования в течение 12 лет. В 1656 году Бойль перебирается в Оксфорд, а в 1668 году переезжает в Лондон.
Он родился 25 января 1627 года в Лисморе (Ирландия), а образование получил в Итонском колледже (1635-1638) и в Женевской академии (1639-1644). После этого почти безвыездно жил в своем имении в Столбридже, там и проводил свои химические исследования в течение 12 лет. В 1656 году Бойль перебирается в Оксфорд, а в 1668 году переезжает в Лондон.
Научная деятельность Роберта Бойля была основана на экспериментальном методе и в физике, и в химии, и развивала атомистическую теорию. В 1660 году он открыл закон изменения объема газов (в частности, воздуха) с изменением давления. Позднее он получил имя закона Бойля-Мариотта: независимо от Бойля этот закон сформулировал французский физик Эдм Мариотт.
Бойль много занимался изучением химических процессов -- например, протекающих при обжиге металлов, сухой перегонке древесины, превращениях солей, кислот и щелочей. В 1654 году он ввел в науку понятие анализа состава тел. Одна из книг Бойля носила название "Химик-скептик". В ней были определены элементы - как " первоначальные и простые, вполне не смешанные тела, которые не составлены друг из друга, но представляют собой те составные части, из которых составлены все так называемые смешанные тела и на которые последние могут быть в конце концов разложены ".
А в 1661 году Бойль формулирует понятие о " первичных корпускулах " как элементах и " вторичных корпускулах " как сложных телах.
Он также впервые дал объяснение различиям в агрегатном состоянии тел. В 1660 году Бойль получил ацетон, перегоняя ацетат калия, в 1663 году обнаружил и применил в исследованиях кислотно-основный индикатор лакмус в лакмусовом лишайнике, произрастающем в горах Шотландии. В 1680 году он разработал новый способ получения фосфора из костей, получил ортофосфорную кислоту и фосфин...
В Оксфорде Бойль принял деятельное участие в основании научного общества, которое в 1662 году было преобразовано в Лондонское Королевское общество (фактически это английская Академия наук).
Роберт Бойль умер 30 декабря 1691 года, оставив будущим поколениям богатое научное наследие. Бойлем было написано множество книг, некоторые из них вышли в свет уже после смерти ученого: часть рукописей была найдена в архивах Королевского общества.
Эдм МАРИОТТ (1620 - 12.V 1684) - французский физик, член Парижской Академии Наук (1666), один из ее основателей. Родился в Дижоне. Был игуменом монастыря Св.Мартина вблизи Дижона.
Работы относятся к механике, теплоте, оптике. В 1676 установил закон изменения объема данной массы газа от давления при постоянной температуре (закон Бойля - Мариотта; этот закон открыли в 1661 Р.Бойль и Р.Тоунли). Предсказал разнообразные применения этого закона, в частности расчет высоты местности по данным барометра. Экспериментально подтвердил формулу Торричелли относительно скорости истечения жидкости, исследовал высоту подъема фонтанов, составил таблицы зависимости высоты подъема от диаметра отверстия. Изучал столкновение упругих тел, колебания маятника. В "Трактате об ударе или соударении тел" (1678) обобщил исследования в этой области. Доказал увеличение объема воды при замерзании. Обнаружил в 1666 слепое пятно в глазу, исследовал цвета, в частности цветные кольца вокруг Солнца и Луны, изучал радугу, дифракцию света, лучистую теплоту, показал отличие между тепловыми и световыми лучами. Изготовил немало различных физических приборов.
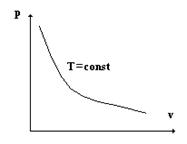
Закон Бойля-Мариотта открыт английским физиком Бойлем в 1664 году и независимо от него французским химиком Мариоттом в 1676 году. Закон гласит - при постоянной температуре T = const, v 1 /v2= p2/p 1объем, занимаемый газом, обратно пропорционален его давлению или
pv = const.
В координатах pv закон изображается гиперболой, которая носит название изотермы.
 |
Закон Гей-Люссака открыт французским физиком Жозефом Луи Гей-Люссаком в 1802 году. Закон гласит: при постоянном давлении p = const удельные объемы одного и того же газа изменяются прямо пропорционально абсолютным температурам
v 1 /v 2 = T 1 /T 2.
В координатах pv закон изображается прямой, которая носит название изобары.
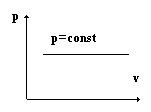
Жозеф Луи Гей-Люссак,физик и химик. Родился 6 декабря 1778 в Сен-Леонар-де-Нобла (департамент Верхняя Вьенна). В 1800 окончил Политехническую школу в Париже и стал ассистентом К.Бертолле. С 1809 – профессор химии Политехнической школы и профессор физики в Сорбонне, с 1832 – профессор химии Парижского ботанического сада. В 1802 независимо от Дж.Дальтона Гей-Люссак открыл один из газовых законов – закон теплового расширения газов, позже названный его именем. В 1804 совершил два полета на воздушном шаре (поднявшись на высоту 4 и 7 км), во время которых выполнил ряд научных исследований, в частности измерил температуру и влажность воздуха. В 1805 совместно с А.Гумбольдтом установил состав воды, показав, что соотношение водорода и кислорода в ее молекуле равно 2:1. В 1808 Гей-Люссак открыл закон объемных отношений, который представил на заседании Философско-математического общества: «При взаимодействии газов их объемы и объемы газообразных продуктов соотносятся как простые числа». В 1809 провел серию опытов с хлором, подтвердивших вывод Г.Дэви, что хлор – это элемент, а не кислородсодержащее соединение. В 1810 установил элементарный характер калия и натрия, затем фосфора и серы. В 1811 начал обстоятельное исследование синильной кислоты, что привело его к концепции водородных кислот, опровергающей чисто кислородную теорию А.Лавуазье.
Гей-Люссак работал во многих государственных комиссиях и составлял по поручению правительства доклады с рекомендациями по внедрению научных достижений в промышленность. Прикладное значение имели и многие его исследования. Так, его метод определения содержания этилового спирта был положен в основу практических способов определения крепости алкогольных напитков. В 1830 были впервые проведены гигрометрические определения серебра в сплавах по способу, разработанному Гей-Люссаком. Созданная им конструкция башни для улавливания оксидов азота в дальнейшем нашла применение в производстве серной кислоты.
В 1806 Гей-Люссак был избран членом Французской академии наук; состоял членом Аркёйского научного общества (Societe d"Archueil), основанного Бертолле. В 1839 он получил титул пэра Франции. Умер Гей-Люссак в Париже 9 мая 1850.
Содержание уравнения состояния для идеального газа может быть получено на основании выводов молекулярно-кинетической теории газов.
Температура газа связана со стредней кинетической энергией движения молекул соотношением
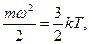
где m - масса молекул, - средняя скорость молекул, k - постоянная Больцмана.
 Лю́двиг Бо́льцман (нем. Ludwig Eduard Boltzmann) родился в Вене 20 февраля 1844 (1844-02-20)в семье акцизного чиновника. Вскоре семья переехала в Вельс, а затем в Линц, где Больцман окончил гимназию. В 1866 он окончил Венский..университет, где учился у Й. Стефана и И. Лошмидта, и защитил докторскую диссертацию. В 1867 г. стал приват-доцентом Венского университета и в течение двух лет являлся ассистентом профессора Й. Стефана. Лю́двиг Бо́льцман (нем. Ludwig Eduard Boltzmann) родился в Вене 20 февраля 1844 (1844-02-20)в семье акцизного чиновника. Вскоре семья переехала в Вельс, а затем в Линц, где Больцман окончил гимназию. В 1866 он окончил Венский..университет, где учился у Й. Стефана и И. Лошмидта, и защитил докторскую диссертацию. В 1867 г. стал приват-доцентом Венского университета и в течение двух лет являлся ассистентом профессора Й. Стефана. |
В 1869 г. Больцман был приглашен на должность ординарного профессора математической физики в Грацском университете с обязательством читать курс «Элементы высшей математики». В 1873 г. стал ординарным профессором математики Венского университета, сменив в этой должности своего наставника Мотта. Однако вскоре (в 1876 г.) вернулся в Грац, где стал профессором экспериментальной физики и директором Физического института, нового учреждения, где в свое время работали В. Нернст и С. Аррениус. Став известным теоретиком, Больцман в 1890 г. получил кафедру теоретической физики в Мюнхене, однако в 1895 г. вернулся в Вену в качестве преемника Й. Стефана по должности профессора теоретической физики. Однако спокойно вести научную и педагогическую работу Больцману не удавалось, поскольку в это время профессором философии Венского университета был Э. Мах, который в своих лекциях отрицал атомистические представления, лежавшие в основе больцмановской теории. Поэтому в 1900 г. он отправляется преподавать в Лейпциг, однако там сталкивается с сопротивлением другого анти-атомиста В. Оствальда. Наконец, в 1902 г. Больцман вновь вернулся в Вену, где занял (помимо кафедры теоретической физики) еще и освобожденную Махом кафедру натурфилософии, обеспечив себе таким образом комфортные условия для работы. Больцман многократно приглашался читать лекции в различных университетах Европы и Америки. Член Австрийской академии наук (1895), член-корреспондент Петербургской академии наук (1899) и ряда других. Покончил с собой в гостиничном номере в итальянском Дуино 5 сентября 1906(1906-09-05) (62 года), повесившись на оконном шнуре. Самоубийство Больцмана связывают с депрессией, вызванной тем, что идеи развиваемой им статистической физики в то время не находили понимания в физическом сообществе. На могильном камне Больцмана выбита установленная им формула S = k ln W, связывающая энтропию S термодинамического состояния с числом соответствующих микросостояний W. Коэффициент 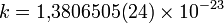 Дж·К−1 носит название постоянной Больцмана. Работы Больцмана касаются преимущественно кинетической теории газов, термодинамики и теории излучения, а также некоторых вопросов капиллярных явлений, оптики, математики, механики, теории упругости и т.д. Перечислим основные достижения Больцмана в области статистической механики. В 1866 получил формулу для равновесного распределения по импульсам и координатам молекул идеального газа, находящегося во внешнем потенциальном поле (распределение Больцмана). В 1871 предложил эргодическую гипотезу для обоснования закономерностей статистической физики. В 1872 вывел основное уравнение микроскопической теории неравновесных процессов (физической кинетики), носящее его имя, а также установил так называемую H-теорему, выражающую закон возрастания энтропии для изолированной системы. В 1872 показал статистический характер второго начала термодинамики, связав энтропию замкнутой системы с числом возможных микросостояний, реализующих данное макросостояние. Это стало указанием на несостоятельность представления о «тепловой смерти Вселенной» Важное значение имели труды Больцмана по термодинамике излучения. В 1884 вывел закон для испускательной способности абсолютно черного тела с учётом пропорциональности давления равновесного излучения, предсказанного теорией Максвелла, плотности его энергии. Этот закон был эмпирически получен Й. Стефаном в 1879 и носит название закона Стефана — Больцмана. Экспериментальные исследования Больцмана посвящены проверке максвелловской теории электромагнетизма, измерению диэлектрических постоянных различных веществ и их связи с показателем преломления, изучению поляризации диэлектриков. Больцман являлся активным сторонником атомистических представлений и отстаивал их в борьбе с представителями махизма и других идеалистических учений (среди них — Э. Мах и В. Оствальд). Дж·К−1 носит название постоянной Больцмана. Работы Больцмана касаются преимущественно кинетической теории газов, термодинамики и теории излучения, а также некоторых вопросов капиллярных явлений, оптики, математики, механики, теории упругости и т.д. Перечислим основные достижения Больцмана в области статистической механики. В 1866 получил формулу для равновесного распределения по импульсам и координатам молекул идеального газа, находящегося во внешнем потенциальном поле (распределение Больцмана). В 1871 предложил эргодическую гипотезу для обоснования закономерностей статистической физики. В 1872 вывел основное уравнение микроскопической теории неравновесных процессов (физической кинетики), носящее его имя, а также установил так называемую H-теорему, выражающую закон возрастания энтропии для изолированной системы. В 1872 показал статистический характер второго начала термодинамики, связав энтропию замкнутой системы с числом возможных микросостояний, реализующих данное макросостояние. Это стало указанием на несостоятельность представления о «тепловой смерти Вселенной» Важное значение имели труды Больцмана по термодинамике излучения. В 1884 вывел закон для испускательной способности абсолютно черного тела с учётом пропорциональности давления равновесного излучения, предсказанного теорией Максвелла, плотности его энергии. Этот закон был эмпирически получен Й. Стефаном в 1879 и носит название закона Стефана — Больцмана. Экспериментальные исследования Больцмана посвящены проверке максвелловской теории электромагнетизма, измерению диэлектрических постоянных различных веществ и их связи с показателем преломления, изучению поляризации диэлектриков. Больцман являлся активным сторонником атомистических представлений и отстаивал их в борьбе с представителями махизма и других идеалистических учений (среди них — Э. Мах и В. Оствальд). |
Давление газа так же связано со средней кинетической энергией движения молекул
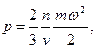
где n - число молекул, v - удельный объем газа. Приравняем кинетическую энергию
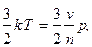
откуда получаем
vp = nkT.
Для одного моля число молекул n = 6.023*1023 (число Авогадро). Постоянная Больцмана равна k = 1.38*10-23. Откуда получаем величину универсальной газовой постоянной R = 8.31 Дж/моль К.
Амедео Авогадро (граф итал. Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e Cerreto; родился 9 августа 1776, умер в Турине — 9 июля 1856) — итальянский учёный, физик, химик.
Изучив право в Турине, он в 1796 получил учёную степень и 20 флореаля IX года (по республиканскому календарю) был назначен секретарём префектуры департамента Эридано. Познакомившись самостоятельно с естественными науками, Авогадро решил посвятить себя им и в 1806 году поступил репетитором в Collegio delle provincie в Турине, а в 1809 перешёл учителем физики в гимназию в Верцелли.
В 1820 Авогадро был назначен профессором математической физики в Туринском университете. Спустя некоторое время эта кафедра была упразднена, и он поступил обратно в магистратуру на место советника счётной палаты, но Карлом-Альбертом был возвращён на кафедру и пробыл в Университете до 1850 г.
Авогадро впервые высказал гипотезу о том, что «одинаковые объёмы различных газов, при одинаковых температурах и давлениях, содержат одинаковое число молекул». Первая работа, в которой он изложил эту гипотезу, была напечатана Авогадро в «Journal de Physique par Delamétherie» в 1811 г. (73, р. 58); там же напечатана и вторая его работа (1814 г.), посвящённая тому же вопросу. Гипотеза эта при своём появлении вызвала возражения и, не получив надлежащей оценки, вскоре была почти забыта. Лишь много лет спустя, благодаря особенно Жерару и Канниццаро и тем следствиям, которые вытекали из гипотезы Авогадро, она стала законом Авогадро, который, вместе с положениями термодинамики, лёг в основу теоретической химии.
Соотношение
pv = RT
называется уравнением состояния Клайперона-Менделеева (1834 - 1874). В нашем курсе мы будем использовать не универсальную газовую постоянную R, а удельную R и не удельный объем v, а весь объем V,занимаемый газом
pV = mRT,
где p = Н/м2 - давление газа, V = м3- объем, занимаемй газом, m = кг- масса газа в этом объеме, R = Дж/кг К - удельная газовая постоянная, Т = К - абсолютная температура газа. Удельная газовая постоянная есть энергия, которую необходимо подвести к одному кг газа, чтобы поднять его температуру на один градус.
 Менделеев Д.И., русский ученый, чл.-кор. Петербургской АН (с 1876 г.). Родился 27 января (8 февраля) 1834(18340208) года в селе Верхние Аремзяны неподалёку от Тобольска. Дата смерти: 20 января (2 февраля) 1907(1907-02-02) (72 года).
Менделеев Д.И., русский ученый, чл.-кор. Петербургской АН (с 1876 г.). Родился 27 января (8 февраля) 1834(18340208) года в селе Верхние Аремзяны неподалёку от Тобольска. Дата смерти: 20 января (2 февраля) 1907(1907-02-02) (72 года).
Окончил Главный педагогический институт в Петербурге (1855 г.). В 1855-1856 гг. - учитель гимназии при Ришельевском лицее в Одессе. В 1857-1890 гг. преподавал в Петербургском университете (с 1865 г. - профессор), одновременно в 1863-1872 гг. - профессор Петербургского технологического института. В 1859-1861 гг. находился в научной командировке в Гейдельберге. В 1890 г. покинул университет из-за конфликта с министром просвещения, который во время студенческих волнений отказался принять от Менделеева петицию студентов. С 1892 г. – ученый-хранитель Депо образцовых гирь и весов, которое в 1893 г. по его инициативе было преобразовано в Главную палату мер и весов (с 1893 г. - управляющий).
Научные работы относятся преимущественно к той дисциплине, которую называют общей химией, а также к физике, химической технологии, экономике, сельскому хозяйству, метрологии, географии, метеорологии. Исследовал (1854-1856 гг.) явления изоморфизма, раскрывающие отношения между кристаллической формой и химическим составом соединений, а также зависимость свойств элементов от величины их атомных объемов. Открыл (1860 г.) "температуру абсолютного кипения жидкостей", или критическую. Автор первого русского учебника "Органическая химия" (1861 г.). Работая над трудом "Основы химии", открыл (февраль 1869 г.) один из фундаментальных законов природы - периодический закон химических элементов.
Развил (1869-1871 гг.) идеи периодичности, ввел понятие о месте элемента в периодической системе как совокупности его свойств в сопоставлении со свойствами других элементов. На этой основе исправил значения атомных масс многих элементов (бериллия, индия, урана и др.). Предсказал (1870 г.) существование, вычислил атомные массы и описал свойства трех еще не открытых элементов - "экаалюминия" (открыт в 1875 г. и назван галлием), "экабора" (открыт в 1879 г. и назван скандием) и "экасилиция" (открыт в 1885 г. и назван германием). Затем предсказал существование еще восьми элементов, в том числе "двителлура" - полония (открыт в 1898 г.), "экаиода" - астата (открыт в 1942-1943 гг.), "двимарганца" - технеция (открыт в 1937 г.), "экацезия" - Франция (открыт в 1939 г.). В 1900 г. Менделеев и У. Рамзай пришли к выводу о необходимости включения в периодическую систему элементов особой, нулевой группы благородных газов.
Помимо выявившейся необходимости исправления атомных масс элементов, уточнения формул окислов и валентностей элементов в соединениях, периодический закон направил дальнейшие работы химиков и физиков на изучение строения атомов, установление причин периодичности и физического смысла закона.
Менделеев систематически занимался изучением растворов и изоморфных смесей. Сконструировал (1859 г.) пикнометр - прибор для определения плотности жидкости. Создал (1865-1887 гг.) гидратную теорию растворов. Развил идеи о существовании соединений переменного состава. Исследуя газы, нашел (1874 г.) общее уравнение состояния идеального газа, включающее как частность зависимость состояния газа от температуры, обнаруженную (1834 г.) физиком Б. П. Э. Клапейроном (уравнение Клапейрона-Менделеева). Выдвинул (1877 г.) гипотезу происхождения нефти из карбидов тяжелых металлов; предложил принцип дробной перегонки при переработке нефтей. Выдвинул (1880 г.) идею подземной газификации углей. Занимался вопросами химизации сельского хозяйства. Совместно с И. М. Чельцовым принимал участие (1890-1892 гг.) в разработке бездымного пороха. Создал физическую теорию весов, разработал конструкции коромысла, точнейшие методы взвешивания.
Член многих академий наук и научных обществ. Один из основателей Русского физико-химического общества (1868 г.). В его честь назван элемент № 101 - менделевий. АН СССР учредила (1962 г.) премию и Золотую медаль им. Д. И. Менделеева за лучшие работы по химии и химической технологии.
При всём том, Дмитрий Иванович оставался таким же мальчишкой, как и большинство его сверстников. Сын Дмитрия Ивановича Иван Менделеев вспоминает, что однажды, когда отец был нездоров, он сказал ему: «Ломит всё тело так, как после нашей школьной драки на Тобольском мосту».
Из уравнения состояния следует, что
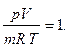
Приведенное соотношение для реальных газов выдерживается далеко не всегда, причем отклонения бывают как в ту так и в другую сторону. Это объясняется тем, что у реальных газов молекулы имеют объем и взаимодействуют друг с другом. В 1873 году Ван-дер-Ваальс опубликовал уравнение состояния для реальных газов, учитывающее эти факты
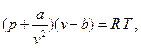
в котором b - учитывет объем молекул, а a/v 2 - взаимодействие молекул. При больших температурах это уравнение укорачивается
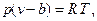
где b - называется ковалюмом (b ~ 0.001vo, vo- удельный объем при нормальных условиях). Последнее уравнение называют уравнением состояния Абеля.
Ян Дидерик Ван-дер-Ваальс (нидерл. Johannes Diderik van der Waals, 23 ноября 1837, Лейден — 8 марта 1923, Амстердам) — голландский физик, лауреат Нобелевской премии по физике в 1910 г.
Ян Ван-дер-Ваальс родился 23 ноября 1837 г. в семье Якобуса Ван-дер-Ваальса, плотника, и Элизабет Ван-дер-Ваальс (в девичестве Ван-ден-Бург).
После окончания школы Ван-дер-Ваальс работал учителем младшей школы в своём родном городе Лейден. Без получения допуска к учёбе в университете (Abitur, вольнослушатель), он посещал тем не менее с 1862 по 1865 гг. лекции и семинары в Лейденском университете. Таким образом ему удалось расширить свой сертификат учителя на области физики и математики в средней школе. С 1864 г. он занял должность учителя в Девентере. С 1866 г. работал в школе в Гааге, где впоследствии стал директором. После изменения законов у него появилась возможность продолжить обучение в университете. Удостоен Лейденским университетом учёной степени доктора философии в 1873 г. за диссертацию, признаваемую ныне классической: «Over de Continuiteit van den Gas — en vioeistoftoestand» (немецкий перевод появился в Лейпциге в 1881 г.). Джеймс Клерк Максвелл, сказал о работе Ван-дер-Ваальса: "Она сразу поставила его имя в один ряд с самыми выдающимися именами в науке".
С открытием Амстердамского университета (1877) занимает в нём профессуру физики, и работает там с 1877 по 1908 г.
Большая часть работ В. относится к области теоретической молекулярной физики. Ван-дер-Ваальс исследовал поведение молекул и занимался теориями, описывающими состояния материи. В 1869 г. он открыл силы взаимодействия между молекулами, которые впоследствии были названы его именем — силы Ван-дер-Ваальса. В 1873 г. в рамках своей диссертации он развил модель описывающую непрерывно газообразную и жидкую фазы вещества. На основе этой модели он вывел уравнение состояния, которое показало, что агрегатные состояния газа и жидкости не только переходят друг в друга, но базируются на одном физическом принципе.
За это достижение Ван-дер-Ваальс получил в 1910 г. Нобелевскую премию по физике «за работу над уравнением состояния газов и жидкостей».
 2014-02-09
2014-02-09 2516
2516
