ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Кафедра «Химия»
«УТВЕРЖДАЮ»
Заведующий кафедрой «Химия»
Профессор, д.т.н. Ю.Перелыгин
«____»______________ 2013 г.
ТЕКСТ ЛЕКЦИИ № 6
по дисциплине «Химия»
п о специальности 200100 «Приборостроение»
Тема № 4. Основные закономерности протекания химических процессов
Занятие №3. Химическое равновесие
Текст лекции обсужден на заседании ПМК №__ кафедры «Химия» «___»____________ 2013 г., протокол №_____
Г. Пенза
Содержание
Введение
1. Основные понятия и определения.
2. Константа химического равновесия.
3. Смещение химического равновесия. Принцип Ле Шателье.
4. Заключение.
Литература:
1. Стромберг А.Г., Семченко Д.П. Физическая химия. Учебник. – М.: Высшая школа, 2001. – с. 142 - 152.
Учебно – материальное обеспечение:
1.Мультимедийный проектор.
Цель занятия:
Знать: Обратимые химические реакции. Состояние химического равновесия. Константа равновесия. Условия смещения равновесия. Прин-цип Ле Шателье.
2. Влияние изменения температуры на состояние равновесия. Влияние изменения давления на состояние равновесия. Влияние изменения концентраций на состояние равновесия.
Ознакомиться: с расчетом константы химического равновесия по известному значению стандартной энергии Гиббса химической реакции.
Организационно-методические указания:
1.Проверить наличие обучаемых и их готовность к занятиям, устранить недостатки.
2.Объявить тему и цель занятия, учебные вопросы, литературу.
3.Обосновать необходимость изучения данной темы.
4.Рассмотреть учебные вопросы с применением кадров презентации.
5.По каждому учебному вопросу и в конце занятия подвести итоги.
6.В конце занятия выдать задание на самоподготовку.
ВВЕДЕНИЕ
Центральным в химии является учение о превращениях веществ, в том числе об энергетике и кинетике химических реакций. Усвоение этого учения позволит предсказывать возможность и направление химических и физико-химических процессов, рассчитывать энергетические эффекты и энергозатраты, скорость получения и выход продуктов реакции, воздействовать на скорость химических процессов, а также предупреждать нежелательные реакции в тех или иных устройствах и приборах. Все химические реакции, как бы многообразны они ни были, можно разбить на две группы: обратимые и необратимые. Разделом химии, который изучает обратимые и необратимые реакции, является учение о химическом равновесии.
Обратимость химических реакций
Реакции, которые могут одновременно протекать в двух противоположных направлениях, называются обратимыми. Необратимые реакции могут протекать только в одном направлении.

Химическое равновесие
Концентрация с
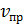
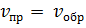
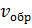
Время 
Рис.1. Изменение скорости прямой (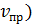 и обратной (
и обратной (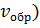 реакций с течением времени
реакций с течением времени 
На рисунке 1 показано, как изменяются скорости прямой и обратной реакций с течением времени. Вначале, при смешении исходных веществ, скорость прямой реакции велика, а скорость обратной реакции равна нулю. По мере протекания реакции исходные вещества расходуются и их концентрации падают. Но мы знаем, что скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ. Поэтому и скорость прямой реакции при этом уменьшается. Одновременно появляются продукты реакции и их концентрация возрастает. Вследствие этого начинает идти обратная реакция, причем ее скорость постепенно увеличивается.
Когда скорости прямой и обратной реакций становятся одинаковыми, наступает химическое равновесие.
Такое состояние системы, когда в ней протекают два противоположно направленных процесса с одинаковой скоростью, называется состоянием химического равновесия.
Так, в реакции 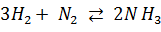 устанавливается равновесие между азотом, водородом и аммиаком. При этом сколько новых молекул аммиака образуется в единицу времени в ходе прямой реакции, ровно столько же других молекул аммиака разлагается в ходе обратной реакции. Так как обе реакции при этом протекают, такое равновесие называется динамическим. В условиях химического равновесия концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. В дальнейшем равновесные концентрации будем обозначать символом вещества в квадратных скобках. Например, равновесные концентрации водорода и аммиака будут обозначаться
устанавливается равновесие между азотом, водородом и аммиаком. При этом сколько новых молекул аммиака образуется в единицу времени в ходе прямой реакции, ровно столько же других молекул аммиака разлагается в ходе обратной реакции. Так как обе реакции при этом протекают, такое равновесие называется динамическим. В условиях химического равновесия концентрации исходных веществ и продуктов реакции не изменяются во времени и называются равновесными концентрациями. В дальнейшем равновесные концентрации будем обозначать символом вещества в квадратных скобках. Например, равновесные концентрации водорода и аммиака будут обозначаться 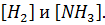
 2020-10-12
2020-10-12 158
158







