Количественной характеристикой химического равновесия служит величина, называемая константой химического равновесия. Рассмотрим ее на примере реакции синтеза иодоводорода:
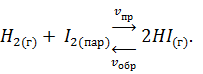
Согласно закону действующих масс скорости прямой  и обратной
и обратной  реакций выражаются уравнениями:
реакций выражаются уравнениями:
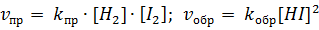 .
.
При наступлении химического равновесия 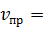
 ⇒
⇒
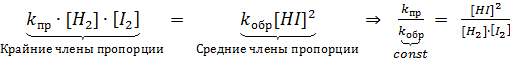 .
.
Отношение констант скорости прямой и обратной реакций тоже представляет собой константу. Она называется константой равновесия данной реакции.
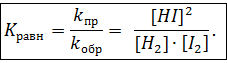
В общем виде для обратимой реакции
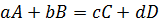
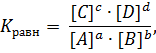
где 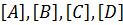 – равновесные концентрации веществ (моль/л).
– равновесные концентрации веществ (моль/л).
Химическое равновесие в гетерогенных системах
Для гетерогенных систем газ – твердое вещество, жидкость – твердое вещество необходимо помнить, что концентрации твердых веществ, участвующих в реакции, остаются постоянными и включаются в константу скорости.
Пример.
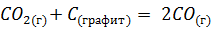

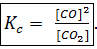
Кроме этого, существуют и другие гетерогенные системы, например, могут реагировать твердое тело и жидкость, две несмешивающиеся жидкости или два твердых вещества. Описание этих систем является достаточно сложным и в нашем курсе химии не рассматривается.
Если характеризовать состав системы молярными концентрациями c, то константу равновесия обычно обозначают 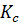 (см. выше).
(см. выше).
Если характеризовать состав системы парциальными давлениями  то константу равновесия обозначают
то константу равновесия обозначают 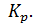 Так, например, для реакции
Так, например, для реакции 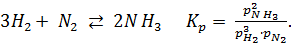
 2020-10-12
2020-10-12 333
333








