| Элемент | Al | B | C | Cd | Cl | F | Ga | H | ||
| c | 1,5 | 2,0 | 2,5 | 1,7 | 3,0 | 4,0 | 1,6 | 2,1 | ||
| Элемент | Hg | N | P | Pb | Si | Sn | Zn | О | ||
| c | 1,9 | 3,0 | 2,1 | 1,9 | 1,8 | 1,8 | 1,6 | 3,5 |
Решение. В молекуле CO2(О=С=О) атомы кислорода равноценны и связаны с углеродом двойной связью.
1. Электронные конфигурации внешних уровней атомов, образующих молекулу, приведены на рис. 8.
С …2 s 22 p 2 O …2 s 22 p 4
| 2 s | 2 px | 2 py | 2 pz | 2 s | 2 px | 2 py | 2 pz | |
| | | | | ¯ | ||||
| ¯ | ¯ |
Рис. 8
2. Определяем электроны, за счет которых будет образовываться химическая связь: С – все четыре электрона (2 s 22 p 2Þ 2 s 12 p 3), О – по два р -электрона (2 px, 2 py).
3. Определяем необходимость гибридизации и ее тип. Поскольку С имеет две двойные связи, одна из них должна быть p-связью (рy - и pz -электроны) и атомы О равноценны, то оставшиеся s - и px -элект-роны гибридизуются (sp -гибридизация). Определяем пространственную ориентацию гибридных орбиталей: sp -гибридные орбитали имеют линейную симметрию, угол связи 180°.
4. Определяем пространственное расположение атомов и характер связей. Молекула CO2 линейна. Атом С по оси x связан с каждым О одной s-связью (перекрывание sp -гибридных орбиталей С и px -орбиталей О), а рy - и pz -орбитали перекрываются с р -орбиталями атомов кислорода по p-типу.
5. Из приведенных значений электроотрицательностей атомов элементов cО = 3,5 и cС = 2,5 (табл. 2) следует, что связи поляризованы. На атоме углерода С избыточный положительный +d-заряд, на атоме О отрицательный -d-заряд.
6. Вследствие симметричного линейного строения молекулы
CO2 центры тяжести +d и -d зарядов совпадают, она не является диполем.
Пример 5. Используя принципы метода молекулярных орбиталей (ММО), составить энергетическую диаграмму молекулы Cl2, написать электронную конфигурацию и определить кратность связи.
Решение. 1. Электронные конфигурации внешних уровней атомов Сl, образующих молекулу Cl2: Сl…3 s 23 p 5. Определяем АО, образующие молекулярные орбитали (МО).
2. Составляем энергетическую диаграмму МО молекулы хлора (рис. 9, а). Молекулы атомов второго периода с зарядом ядра Z £ 7 за счет взаимодействия s - и px -орбиталей имеют другой энергетический порядок расположения МО – рис. 9, б.
3. Заполняем молекулярные орбитали электронами АО. Суммарное число электронов распределяют по МО с учетом принципов заполнения электронных орбиталей:
s -электроны 4 шт. (2 + 2) sсв – 2 sр – 2
р -электроны 10 шт. (5 + 5) pсв – 4 sсв – 2 pр – 4.
| б) |
| а) |

Рис. 9
4. Электронная конфигурация молекулы:
sсв2sр2pсв4sсв2pр4.
5. Кратность связи: восемь электронов на связывающих орби-талях, шесть – на разрыхляющих КС = (8 − 6)/2 = 1. КС = (число е
на связывающих МО минус число электронов на разрыхляющих МО)/2.
6. Молекула хлора диамагнитна − отсутствие неспаренных электронов на МО (при наличии неспаренных электронов молекула парамагнитна).
4. Валентность и степень окисления химических элементов.
Типы химических реакций. Окислительно-восстановительные реакции. Метод электронного баланса
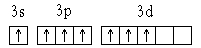
Валентность − это число связей, которые данный атом может образовать с другими атомами. Валентность не имеет знака. Например, валентность азота в молекуле N2 или в молекуле аммиака NH3 равна 3, так как в образовании связи участвуют три валентных (неспаренных) электрона.
При определении валентности следует учитывать возможность электронов при возбуждении атома занимать имеющиеся свободные орбитали. Например, электронное строение атома хлора, как известно1 s 22 s 22 p 63 s 23 p 5. Атом хлора имеет один неспаренный (валентный) электрон и, следовательно, должен быть одновалентным. Наличие у хлора свободных d -орбиталей позволяет атому в «возбужденном» состоянии занимать как р -, так и s -электроны. При этом атом хлора последовательно становится трех, пяти- и семивалентным.
Таким образом, максимальная валентность атома хлора равна количеству неспаренных электронов на внешнем уровне в возбужденном состоянии, т.е. семи:
Степень окисления − условный заряд атома в химическом соединении, вычисленный исходя из предположения, что все атомы в молекуле являются ионами, а сама молекула электронейтральна. В отличие от валентности степень окисления может быть (+), (−) и равной нулю − Са+2, Cl-, N2 0.
При определении степени окисления нужно помнить следующее:
1. Атомы более электроотрицательных элементов имеют отрицательную степень окисления, а менее отрицательных − положительную.
2. Степень окисления атомов в молекулах простых веществ (Н2, С, О2, N2, Cl2) равна нулю.
3. Металлы во всех соединениях имеют только положительные степени окисления.
4. Высшая степень окисления элемента, как правило, равна номеру группы, в которой находится элемент.
5. Сумма степеней окисления элементов в ионе равна заряду иона.
Химическая реакция – это взаимодействие молекул, атомов и
ионов, которое приводит к изменению их физическо-химических свойств без изменения природы химических элементов. В ходе хи-мической реакции исходные реагенты превращаются в продукт реакции.
Химические реакции делятся на следующие виды:
· необратимые, когда исходное вещество полностью превращается в продукты:
2H2+O2→2H2O (гремучая смесь);
· обратимые, в ходе которых устанавливается равновесие между исходными веществами и продуктами:
N2+3H3 ↔ 2NH3– синтез аммиака;
· экзотермические, идущие с выделением тепла:
CaO + H2O → Ca(OH)2 – гашение извести;
·
| t |
CaCО3 → CaО + CO2 – термическая реакция разложения CaCO3;
· гомогенные, когда все участники реакции находятся в одной фазе (например, газы):
2CO + О2 → CO2;
· гетерогенные, когда участники реакции находятся в разных фазах:
С (тв.) + О2 (газ) = СО2 (газ) – горение графита;
· обмена, когда участники реакции обмениваются своими составными частями:
AgNO3 + HCl = AgCl↓ + HNO3;
· нейтрализации − взаимодействия гидроксидов и кислот с образованием соли и воды:
NaOH + HCl → NaCl + H2O.
Окислительно-восстановительные реакции (ОВР) – реакции, идущие с изменением степени окисления атомов химических элементов.
Окислитель – участник ОВР, принимающий электроны. В результате реакции окислитель восстанавливается. Типичным окислителем является кислород. Например, в реакции О2 + 2Н2О + 4 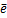 4ОН--О20 – окислитель, восстанавливается до О−2.
4ОН--О20 – окислитель, восстанавливается до О−2.
Восстановитель – участник ОВР, отдающий электроны. В результате реакции восстановитель окисляется. Например, Al0+O20 → → Al2+3O3−2, Al0 – восстановитель, отдает 3 е и окисляется до (+3).
Для составления уравнений окислительно-восстановительных реакций используют два метода [4]: метод электронного баланса и метод полуреакций (электронно-ионного баланса). В обоих методах следует соблюдать баланс по электронам и по массе.
Баланс по электронам означает равенство электронов, отданных восстановителем и принятых окислителем.
Баланс по массе означает, что количество атомов любого химического элемента, участвующего в реакции слева и справа в уравнении реакций, должно быть одинаковым.
В методах электронного баланса, сравнивая степени окисления элементов слева и справа уравнения реакций, определяют окислитель и восстановитель. Затем записывают реакцию окислителя и реакцию восстановителя, после чего уравнивают количества отданных и принятых электронов.
 2020-10-09
2020-10-09 148
148








