Растворами называются однородные гомогенные системы переменного состава, состоящие из двух или более компонентов (составных частей). Любой раствор состоит из растворителя и растворенного вещества. Растворитель является средой, в которой растворяемые вещества равномерно распределяются в виде различных частиц – молекул, атомов, ионов, которые связаны друг с другом силами физического или химического взаимодействия.
Растворы могут существовать в любом из трех агрегатных состояний: жидком, твердом и газообразном. Растворителем обычно называют вещество, которое в процессе приготовления раствора не изменяет агрегатного состояния. Если же оба компонента в чистом виде находятся в одном и том же агрегатном состояние (например, этиловый спирт и вода), то растворителем считается тот компонент, который находится в избытке.
Растворение многих веществ сопровождается соответствующим тепловым эффектом, что указывает на происходящее при этом химическое взаимодействие растворителя и растворенного вещества. Такое взаимодействие носит название сольватации или, в случае водных растворов, – гидратации.
Концентрация показывает содержание растворенного вещества в единице массы (объема) раствора.
Массовая концентрация (процентная концентрация раствора по массе) w показывает, сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора:
 , (1)
, (1)
Молярная концентрация (или мольная) показывает число молей растворенного вещества, содержащихся в 1 л раствора, С – обозначение молярной концентрации, моль/л. Молярную концентрацию раствора (моль/л) рассчитывают по формуле
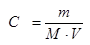 ,
,
где m – масса растворенного вещества, г; M – молярная масса растворенного вещества, г/моль; V – объем раствора, л (см3, мл).
Для определения массы раствора часто используют значения плотности раствора ρ (кг/м3, г/см3) и его объем V (м3, см3, мл):
m раствора = V раствора. ρраствора (кг, г).
Моляльная концентрация показывает, сколько молей вещества содержится в 1 кг растворителя:
Cмол = 1000∙ m р.в-ва/ М р.в-ва∙ М р-теля,
где m р. в- ва – масса растворенного вещества, г; M р. в-ва – молярная масса растворенного вещества г/моль; М р-теля − молярная масса растворителя, г/моль.
Нормальная концентрация показывает, сколько грамм-эквива-лентов растворенного вещества содержится в 1 л раствора. Нормальность определяют по формуле
N = m р.в-ва∙1000/Э∙ V,
где m р.в-ва − масса растворенного вещества, г; Э − эквивалент вещества, г/г-экв.; V − объем раствора, мл.
Эквивалент сложного соединения − масса вещества, выраженная в граммах, которая в химических реакциях эквивалентна (равнозначна) 1,008 г водорода или 8,000 г кислорода:
Экислоты = М кислоты/ n; Эоснования = М основания/В; Эсоли = М соли/В∙И,
где М − молярные массы, г/моль; n – количество атомов водорода в молекуле кислоты; В − валентность металла; И − индекс металла. Во всех химических реакциях взаимодействуют эквивалентные количества веществ, независимо от того, являются эти вещества простыми или сложными.
 2020-10-09
2020-10-09 110
110








