Очистка коллоидных систем
Некоторые молекулярно-кинетические свойства коллоидных систем используют для очистки золей от электролитов и молекулярных примесей, которыми полученные золи часто бывают загрязнены. Наиболее распространенными методами очистки коллоидных систем являются диализ, электродиализ и ультрафильтрация, основанные на свойстве некоторых материалов – т.н. полупроницаемых мембран (коллодия, пергамента, целлофана и т.п.) – пропускать ионы и молекулы небольших размеров и задерживать коллоидные частицы. Все полупроницаемые мембраны представляют собой пористые тела, и непроницаемость их для коллоидных частиц обусловлена тем, что коэффициент диффузии для коллоидных частиц значительно (на несколько порядков) меньше, чем для ионов и молекул, имеющих намного меньшие массу и размеры.
Прибор для очистки золей методом диализа называется диализатором; простейший диализатор представляет собой сосуд, нижнее отверстие которого затянуто полупроницаемой мембраной (рис. 4.17). Золь наливают в сосуд и помещают последний в ёмкость с дистиллированной водой (обычно проточной); ионы и молекулы примесей диффундируют через мембрану в растворитель.
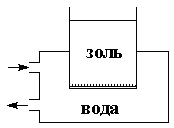 | 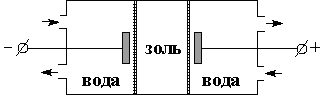 |
| Рис. 4.17 Схема диализатора | Рис. 4.18 Схема электродиализатора |
Диализ является очень медленным процессом; для более быстрой и полной очистки золей применяют электродиализ. Электродиализатор состоит из трех частей; в среднюю часть, отделенную от двух других полупроницаемыми мембранами, за которыми помещены электроды, наливается золь (рис. 4.18). При подключении к электродам разности потенциалов катионы содержащихся в золе электролитов диффундируют через мембрану к катоду, анионы – к аноду. Преимущество электродиализа заключается в возможности удаления даже следов электролитов (необходимо помнить, что степень очистки ограничивается устойчивостью коллоидных частиц; удаление из золя ионов-стабилизаторов приведет к коагуляции).
Еще одним методом очистки золей является ультрафильтрация – отделение дисперсной фазы от дисперсионной среды путем фильтрования под давлением через полупроницаемые мембраны. При ультрафильтрации коллоидные частицы остаются на фильтре (мембране).
Оптические свойства коллоидных систем
Особые оптические свойства коллоидных растворов обусловлены их главными особенностями: дисперсностью и гетерогенностью. На оптические свойства дисперсных систем в значительной степени влияют размер и форма частиц. Прохождение света через коллоидный раствор сопровождается такими явлениями, как поглощение, отражение, преломление и рассеяние света. Преобладание какого-либо из этих явлений определяется соотношением между размером частиц дисперсной фазы и длиной волны падающего света. В грубодисперсных системах в основном наблюдается отражение света от поверхности частиц. В коллоидных растворах размеры частиц сравнимы с длиной волны видимого света, что предопределяет рассеяние света за счёт дифракции световых волн.
Светорассеяние в коллоидных растворах проявляется в виде опалесценции – матового свечения (обычно голубоватых оттенков), которое хорошо заметно на тёмном фоне при боковом освещении золя. Причиной опалесценции является рассеяние света на коллоидных частицах за счёт дифракции. С опалесценцией связано характерное для коллоидных систем явление – эффект Тиндаля: при пропускании пучка света через коллоидный раствор с направлений, перпендикулярных лучу, наблюдается образование в растворе светящегося конуса.
Процесс дифракционного светорассеяния на частицах, размер которых значительно меньше длины волны описывается уравнением Рэлея, связывающим интенсивность рассеянного единицей объёма света I с числом частиц в единице объёма ν, объёмом частицы V, длиной волны λ и амплитудой А падающего излучения и показателями преломления дисперсной фазы и дисперсионной среды n1 и n2 соответственно:
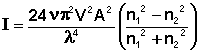 (IV.24)
(IV.24)
Из уравнения (IV.18) видно, что, чем меньше длина волны падающего излучения, тем больше будет рассеяние. Следовательно, если на частицу падает белый свет, наибольшее рассеивание рассеяние будут испытывать синие и фиолетовые компоненты. Поэтому в проходящем свете коллоидный раствор будет окрашен в красноватый цвет, а в боковом, отраженном – в голубой.
На сравнении интенсивности светорассеяния золей, один из которых имеет известную концентрацию (степень дисперсности), основан метод определения концентрации либо степени дисперсности золя, называемый нефелометрией. На использовании эффекта Тиндаля основывается ультрамикроскоп – прибор, позволяющий наблюдать коллоидные частицы размером более 3 нанометров в рассеянном свете (в обычном микроскопе можно наблюдать частицы с радиусом не менее 200 нм из-за ограничений, связанных с разрешающей способностью оптики).
Контрольные вопросы:Ответы отправить на почту или вк
1. Охарактеризуйте способы получения золей путем конденсации.
2. Какие условия необходимы для осуществления химической конденсации?
3.От чего и для чего очищают коллоидные системы?
4. Что такое диализ? Изобразите схему аппарата для проведения диализа.
5. Как можно ускорить диализ?
6. Что такое ультрафильтрация и чем она отличается от диализа? Дайте определение мембраны. 7. Что общего и в чем заключается особенность таких мембранных процессов, как диализ и ультрафильтрация?
14.04.2020 г. занятие № 60
Тема: Электрокинетические явления
Содержание. Электроосмос и электрофорез. их использование Устойчивость и коагуляция золей. Факторы, вызывающие коагуляцию. Коллоидная защита. Пептизация. Строение коллоидных частиц. Правило Пескова-Фаянса
Задание: написать конспект:
Электрокинетическими называют такие явления, которые возникают при воздействии электрического поля на дисперсные системы и в результате перемещения частиц дисперсной фазы или дисперсионной среды. Несмотря на различие электрокинетических явлений все они связаны с наличием ДЭС и определяются ξ-потенциалом. Если поместить мицеллу в постоянное электрическое поле, то наблюдаются электрокинетические явления: 1) Электрофорез Электрофорез - это перемещение под действием электрического поля частиц дисперсной фазы относительно дисперсионной среды
2) Электроосмос Электроосмосом называют перемещение дисперсионной среды под действием внешнего электрического поля. Движение дисперсионной среды обусловлено притяжением разноименных зарядов. 3) Потенциал седиментации возникает при седиментации (оседании) частиц дисперсной фазы за счет избыточного заряда частиц, определяемого ξ-потенциалом. Частицы дисперсной фазы оседают под действием гравитации. Процесс оседания частиц называют седиментацией. При оседании частиц дисперсионная среда практически остается неподвижной. Частицы движутся совместно с потенциалобразующим слоем ионов и адсорбционным слоем противоионов. Их перемещение относительно жидкой дисперсионной среды происходит по границе скольжения. Потенциал седиментации обратен электрофорезу. 4) Потенциал течения возникает при перемещении жидкой дисперсионной среды. Жидкость движется под влиянием внешнего воздействия: насоса, давления воздуха или какого-либо другого источника. При движении жидкости увлекаются противоионы диффузного слоя. В этом случае, как и в других электрокинетических явлениях, перемещение жидкой дисперсионной среды относительно твердой дисперсной фазы происходит по границе скольжения и приводит к появлению разности потенциалов. Потенциал течения обратен электроосмосу.
Вопросы устойчивости дисперсных систем занимают центральное место в коллоидной химии, поскольку эти системы в основном термодинамически неустойчивы. Под устойчивостью системы понимают постоянство во времени ее состояния и основных свойств: дисперсность равномерного распределения частиц дисперсной фазы в объеме дисперсионной среды и характера взаимодействия между частицами. Частицы дисперсной системы, с одной стороны, испытывают действие земного притяжения; с другой стороны, они подвержены диффузии, стремящейся выровнять концентрацию во всех точках системы. Когда между этими двумя силами наступает равновесие, частицы дисперсной фазы определенным образом располагаются относительно поверхности Земли. По предложению Н.П. Пескова (1920г) устойчивость дисперсных систем подразделяют на два вида:
- кинетическая (седиментационная) устойчивость – свойство дисперсных частиц удерживаться во взвешенном состоянии, не оседая (противостояние частиц силам тяжести). (условия устойчивости – высокая дисперсность частиц, участие частиц дисперсной фазы в броуновском движении);
- агрегативная устойчивость – способность частиц дисперсной фазы оказывать сопротивление слипанию (агрегации) и тем самым сохранять определенную степень дисперсности этой фазы в целом.
Дисперсные системы по устойчивости делят на два класса:
- термодинамически устойчивые (лиофильные коллоиды);
- термодинамически неустойчивые (лиофобные системы). Первые самопроизвольно диспергируются и существуют без стабилизатора. К ним относятся растворы ПАВ, растворы ВМС.
Свободная энергия Гиббса термодинамически устойчивой системы уменьшается (DG<0). К термодинамически неустойчивым системам относятся золи, суспензии, эмульсии (DG>0). В последнее время различают также конденсационную устойчивость: система образует непрочные агрегаты (флокулы) или рыхлые осадки – частицы теряют свою индивидуальную подвижность, но сохраняются как таковые в течение длительного времени. Коагуляция Лиофобные коллоиды являются термодинамически неустойчивыми системами, существующими благодаря стабилизации за счет возникновения защитных ионных или молекулярных слоев. Следовательно, изменение состояния этих слоев может привести к потере устойчивости и затем к выделению дисперсной фазы.
Коагуляция - процесс слипания (слияния) коллоидных частиц с образованием более крупных агрегатов с последующей потерей кинетической устойчивости. В общем смысле под коагуляцией понимают потерю агрегативной устойчивости дисперсной системы. Скрытая стадия коагуляции – очень быстрая – размер частиц увеличивается, но осадок не выпадает – изменение окраски, помутнение. Явная стадия – выпадение осадка, выделение двух фаз в растворе. Осадок называется коагулят. Конечным итогом коагуляции могут быть два результата: разделение фаз и образование объемной структуры, в которой равномерно распределена дисперсионная среда (концентрирование системы). В соответствии с двумя разными результатами коагуляции различают и методы их исследования (для первого результата – оптические, например, для второго – реологические).
Основные процессы, которые могут происходить в дисперсных системах, показаны на рис. 5.1. Из схемы видно, что понятие коагуляция включает в себя несколько процессов (флокуляция, коалесценция, агрегация, структурообразование), идущих с уменьшением удельной поверхности системы.
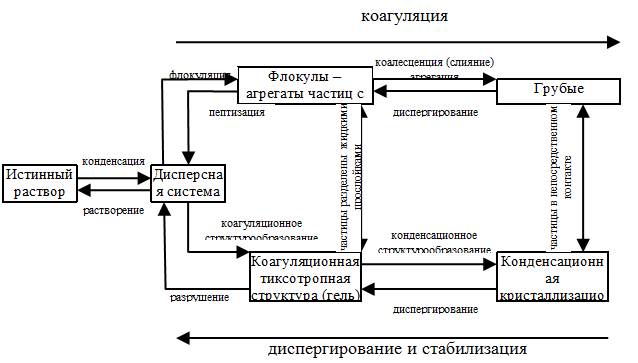
Рис. 5.1. Процессы, происходящие в дисперсных системах.
Коагуляция может быть вызвана разными факторами:
- введением электролитов;
- нагреванием или замораживанием дисперсной системы;
- механическим воздействием;
- высокочастотными колебаниями;
- ультрацентрифугированием и др. факторами.
Наиболее важным и изученным является действие электролитов. Действие электролитов на коагуляцию Установлен ряд эмпирических закономерностей воздействия электролитов, которые известны под названием правил коагуляции:
Любые электролиты могут вызвать коагуляцию, однако заметное воздействие они оказывают при достижении определенной концентрации. Порог коагуляции – минимальная концентрация электролита, вызывающая коагуляцию (g, моль/л; иногда Ск). Порог коагуляции определяют по помутнению, изменению окраски или по началу выделения дисперсной фазы в осадок.
Защитное действие молекулярных адсорбирующих слоев Некоторые системы обладают очень высокой устойчивостью, они даже приобретают способность к самопроизвольному образованию – коллоидную растворимость. В большинстве же золей на границе раздела двух фаз существуют адсорбционные слои, образованные молекулами ПАВ. Адсорбционные слои предохраняют частицы от слипания, но они покрывают не всю поверхность, а приблизительно 40…60% ее. Максимальная устойчивость достигается при образовании полного адсорбционного слоя. Повышение устойчивости дисперсных систем под влиянием ПАВ называют коллоидной защитой или стабилизацией коллоидов. В качестве стабилизаторов используют: высокомолекулярные ПАВ, желатин, альбумин, казеин, крахмал, пектин, каучуки, гемоглобин и др.
Правило Пескова-Фаянса: ядро мицеллы адсорбирует из раствора преимущественно те ионы, которые входят в кристаллическую решетку ядра или являются изоморфным с ним и содержатся в некотором избытке. Изоморфизм- способность частиц замещать друг друга из-за одинаковых размеров.
Методы получения коллоидных растворов:
- Механические – диспергирование (механическое дробление).
- Химические – пептизация (химическое дробление).
- Устойчивость. Кинетическая – постоянство концентрации дисперсной фазы (обусловлена броуновским движением). Агрегативная – постоянство дисперсной фазы (обусловлено наличием у частиц одноименного заряда и как следствие – отталкивание). Более устойчивы гидрофильные золи (коллоидная частица взаимодействует с водой). Гидрофобные золи (смачиваемые водой) менее устойчивы.
- Электрические. Перемещение гранул под действием электрического тока называется электрофорезом. Обусловлено наличием заряда у частиц.
- Оптические. Способность коллоидных растворов рассеивать свет (в отличие от истинных растворов). Вследствии дифракции света на коллоидных частицах в коллоидном растворе происходит светорассеивание, которое становится видимым при наблюдении сбоку (конус Тиндаля).
Коагуляция – укрупнение коллоидных частиц из-за частичной или полной потери электрического заряда при добавлении электролита. При полной потере заряда коагуляция приводит к разрушению коллоидной системы. Гидрофобные золи весьма чувствительны к добавлению электролита. Чем выше заряд коагулирующего иона, тем сильнее его действие. Наименьшая концентрация электролита при которой возникает коагуляция называется порогом коагуляции C=1/z6=Cэл-та*Vэл-та/(Vзоля+Vэл-та). В целом разрушение можно вызвать 4 способами: механическим, электрическим, термическим, добавлением электролита.
Источник: https://studizba.com/lectures/107-himija/1417-kolloidnaja-himija/26137-5-ustojchivost-i-koaguljacija-kolloidnyh-sistem.html
21.04.2020 г. занятие № 61
Тема: Практическое занятие № 7 Загрязнение окружающей среды дисперсными системами: защита окружающей среды.
Содержание
Задание: написать конспект:
Практическое занятие № 7 Загрязнение окружающей среды дисперсными системами: защита окружающей среды
Цель: Определить степень дисперсности и однородности (гранулометрический состав)полимерного материала
Задание:
1. Ознакомиться с теоретическим материалом.
2. Ответить на контрольные вопросы.
3. Ознакомьтесь с правилами по технике безопасности при работе в химической лаборатории и распишитесь в журнале по ТБ
4. Выполнить опыты в соответствии с инструкцией и записать данные в таблицы.
5. Сделать вывод.
 2020-10-10
2020-10-10 2566
2566