Химия входит в число наук, составляющих фундамент медицины. Химические методы исследования постоянно используются в диагностике заболеваний и профилактических обследованиях. Химический синтез является основой изготовления лекарств. Поэтому, для дальнейшего изучения материала, необходимо знать теоретические основы химии. Наряду с теоретической базой, в медицине применяются экспериментальные методы, помогающие освоению материала.
В настоящее время практикуму, как специфической и важнейшей форме учебной работы, уделяется особое внимание, так как усвоение изучаемого материала, может происходить только в ходе активной деятельности самого учащегося. Эта деятельность реализуется на практике и лабораторных занятиях в процессе решения различных ситуационных задач. Без знания техники лабораторных работ нельзя быть уверенным в точности поставленного эксперимента.
Многие химические процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Растворы имеют большое значение, как в промышленности, так и в медицине. Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ (концентрационный гомеостаз). Биологические жидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа и т.д.). Приведенные примеры подчеркивают важность изучения свойств растворов для медиков.
Важной характеристикой раствора является концентрация. Этой величиной определяются многие свойства растворов.
- Цель обучения:
Изучить правила техники безопасности при работе в химической лаборатории. Ознакомиться с основной лабораторной посудой. Изучить способы выражения концентрации растворов: массовую долю, молярную концентрацию, моляльную концентрацию, молярную концентрацию эквивалента, мольную долю. Научиться готовить растворы заданной концентрации.
- Вопросы для обсуждения:
| 1. | Правила работы в лаборатории. Правила техники безопасности. |
| 2. | Оборудование лаборатории. Виды лабораторной посуды: основная лабораторная посуда. |
| 3. | Правила работы с химическими реактивами: общеупотребительные (кислоты, щелочи, ряд солей, индикаторы) и специальные (только для определенных работ) химические реактивы; чистота реактивов (х.ч., ч.д.а., ч.). |
| 4. | Понятия: раствор, растворитель, растворенное вещество. |
| 5. | Способы выражения концентраций (массовая доля, молярность, моляльность, молярная концентрация эквивалента, мольная доля). Закон эквивалентов. |
| 6. | Физические характеристики растворов (коэффициент преломления, плотность). |
| 7. | Биологическое значение и применение растворов. |
4. Задания для самостоятельного решения (выполнить письменно):
| 1. | К какому классу соединений относится следующее вещество: BaO | |
| A | оксид | |
| B | гидроксид | |
| C | пероксид | |
| D | соль основная | |
| 2. | Дать название оксиду по международной номенклатуре: NO2 | |
| A | оксид азота (II) – «веселящий газ» | |
| B | оксид азота (IV) – «бурый газ» | |
| C | оксид азота (I) – «веселящий газ» | |
| D | оксид азота (V) – аммиак | |
| 3. | Определить формулу соли натрия тиосульфат: | |
| A | Na2S2O3 | |
| B | Na2SO4 | |
| C | NaHSO4 | |
| D | NaHSO3 | |
| 4. | Какая из приведенных кислот является одноосновной? | |
| A | Угольная | |
| B | Щавелевая | |
| C | Плавиковая | |
| D | Сернистая | |
| 5. | Дайте название кислоте: H2SO3 | |
| A | тиосерная | |
| B | сероводородная | |
| C | серная | |
| D | сернистая | |
| 6. | Какая из приведенных кислот не может образовать кислую соль? | |
| A | Уксусная | |
| B | Щавелевая | |
| C | Серная | |
| D | Сернистая | |
| 7. | Соли какой кислоты называются перхлораты? | |
| A | Хлорной | |
| B | Хлороводородной | |
| C | Хлорноватой | |
| D | Хлористой | |
| 8. | Определить степень окисления хрома в К2Сr2O7: | |
| A | -6 | |
| B | +7 | |
| C | +4 | |
| D | +6 | |
| 9. | К какому типу солей относится следующее вещество: Cu(OH)Cl | |
| A | соль средняя | |
| B | соль кислая | |
| C | соль двойная | |
| D | соль основная | |
| 10. | К какому типу солей относится следующее вещество: KHCO3 | |
| A | соль средняя | |
| B | соль кислая | |
| C | соль двойная | |
| D | соль основная | |
| 11. | Формула для расчета молярной концентрации: | |
| A | 
| |
| B | 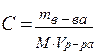
| |
| C | 
| |
| D | 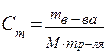
| |
| 12. | Формула для расчета молярной концентрации эквивалента: | |
| A | 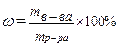
| |
| B | 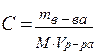
| |
| C | 
| |
| D | 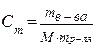
| |
| 13. | Фактор эквивалентности для HCl, H2SO4, H3PO4 равен: | |
| A | 1, 2, 3 | |
| B | 1, ½, 1/3 | |
| C | ½, 1/3, 1/6 | |
| D | ½, 1/3, 1 | |
| 14. | Фактор эквивалентности для Na3PO4, ZnCl2, K2SO3 равен: | |
| A | 3, 1, 2 | |
| B | 1/3, ½, ½, | |
| C | ½, 1/3, 1/6 | |
| D | ½, 1/3, 1 | |
| 15. | Единицы измерения молярной концентрации эквивалента: | |
| A | Моль/л, М | |
| B | Моль/л ∙ экв, N | |
| C | Моль/кг | |
| D | % | |
| 16. | Единицы измерения моляльной концентрации: | |
| A | Моль/л, М | |
| B | Моль/л ∙ экв, N | |
| C | Моль/кг | |
| D | % | |
| 17. | Степень окисления азота в NH4Сl равна: | |
| A | +1 | |
| B | +2 | |
| C | +3 | |
| D | –3 | |
| 18. | 40 г CaCO3 соответствует следующее количество вещества: | |
| A | 0,4 моль | |
| B | 0,2 моль | |
| C | 0,1 моль | |
| D | 0,6 моль | |
| 19. | Химическая реакция между раствором хлорида калия и нитрата серебра является реакцией: | |
| A | нейтрализации | |
| B | гидролиза | |
| C | обмена | |
| D | окислительно-восстановительной | |
| 20. | Какой из элементов имеет высшую степень окисления +7: | |
| A | C | |
| B | Mn | |
| C | S | |
| D | Au |
- Задачи для самостоятельного решения (выполнить письменно):
| 1. | Какая масса соли необходима для приготовления 500 мл 2% раствора бромида калия с плотностью 1,01 г/мл. | |
| 2. | Рассчитать массу Н2SO4, содержащуюся в 100 мл 0,25 М раствора серной кислоты. | |
| 3. | Определите молярную концентрацию эквивалента раствора сульфата магния MgSO4, применяемого внутривенно для снижения давления крови, если массовая доля соли в растворе составляет 20 %, плотность раствора 1,22 г/мл. | |
| 4. | Какова массовая доля (%) пероксида водорода в растворе, применяемом наружно как кровоостанавливающее и дезинфицирующее средство, если молярная концентрация этого раствора составляет 0,89 моль/л, плотность раствора 1 г/мл? |
- Вспомогательные материалы по самоподготовке:
 2020-10-10
2020-10-10 198
198







