| 1. | Предмет и задачи аналитической химии. Качественный и количественный анализ. |
| 2. | Основные понятия качественного анализа: а) аналитические реакции; б) реагент (реактив); в) дробный и систематический метод анализа; г) макро-, микро-, полумикроанализ; д) способы выполнения аналитических реакций. |
| 3. | Методы количественного анализа. Классификация методов количественного анализа. |
| 4. | Закон эквивалентов. Основные понятия объемного (титриметрического) анализа: а) рабочий раствор (титрант); б) исходные вещества, требования к ним; в) анализируемый раствор; г) титрование; д) точка эквивалентности, точка нейтрализации; е) конец титрования. |
| 5. | Индикаторы, выбор индикатора. Понятие о кривых титрования, их анализе. |
| 6. | Метод нейтрализации. Основные реакции метода. Алкалиметрия и ацидиметрия. Техника выполнения метода алкалиметрии. |
| 7. | Значение методов качественного и количественного анализа в медицине и других областях практической деятельности (санитарно-гигиенической практике). |
4. Выполнить тестовые задания (письменно):
| 1. | Какие методы используются при проведении количественного анализа: | |
| А | окрашивание пламени | |
| В | метод парообразования | |
| С | спектрофотометрия | |
| D | метод нейтрализации | |
| 2. | Какой из представленных реагентов можно использовать для качественного определения ионов Cu2+ ? | |
| А | NH4OH | |
| В | NaCl | |
| С | KNO3 | |
| D | FeCl3 | |
| 3. | Аналитические реакции между электролитами записывают: | |
| А | только в ионном виде | |
| В | в ионном виде только слабые электролиты | |
| С | слабые электролиты и малодиссоциированные вещества в молекулярном виде. | |
| D | только в молекулярном виде | |
| 4. | Какая реакция является качественной на ионы СO32-? | |
| А | с ионами Ва2+ | |
| В | с ионами Fe2+ | |
| С | с ионами Na+ | |
| D | с ионами Ca2+ | |
| 5. | Ионы натрия окрашивают бесцветное пламя горелки в: | |
| А | красный цвет | |
| В | желтый цвет | |
| С | фиолетовый цвет | |
| D | зелёный цвет | |
| 6. | Ионы Рb2+ в растворе можно определить в присутствии ионов: | |
| А | SO42- | |
| В | Clˉ | |
| С | I- | |
| D | NO3- | |
| 7. | Осадок какого цвета выпадает в реакции Ba2+ + SO42- ® BaSO4¯ | |
| А | черный | |
| В | желтый | |
| С | белый кристаллический | |
| D | белый творожистый | |
| 8. | Как называется анион SСN-? | |
| А | сульфат – ион | |
| В | роданид – ион | |
| С | тиосульфат – ион | |
| D | сульфит – ион | |
| 9. | Бромид и иодид серебра окрашены соответственно в: | |
| А | бледно-жёлтый и жёлтый цвет | |
| В | жёлтый и черный цвет | |
| С | бледно-жёлтый и белый цвет | |
| D | голубой и белый цвет | |
| 10. | Соли кальция окрашивают пламя горелки в: | |
| А | насыщенный желтый цвет | |
| В | кирпично – красный цвет | |
| С | желтовато – зеленый цвет | |
| D | светло – фиолетовый цвет | |
| 11. | На какой анион третьей группы реакция с солями железа (III) является качественной: | |
| А | NO3- | |
| В | Cl- | |
| С | SCN- | |
| D | SO32- | |
| 12. | Какой закон используют для расчётов в объёмном анализе? | |
| А | Закон Авогадро | |
| В | Закон эквивалентов | |
| С | Закон постоянства состава | |
| D | Закон перехода количества в качество | |
| 13. | Чему равны эквивалентные массы H2SO4 и КOH? | |
| А | 98 и 56 | |
| В | 49 и 28 | |
| С | 49 и 112 | |
| D | 98 и 40 | |
| 14. | Как изменится окраска индикатора фенолфталеина в щелочной среде? | |
| А | С бесцветной на желтую | |
| В | С бесцветной на малиновую | |
| С | С бесцветной на красную | |
| D | С бесцветной на фиолетовую | |
| 15. | Какой раствор является стандартным? | |
| А | Раствор с точно известной концентрацией | |
| В | Раствор, концентрацию активного вещества которого надо установить | |
| С | Раствор, содержащий определенную массовую долю растворённого вещества | |
| D | Раствор, не содержащий активного вещества | |
| 16. | Каким методом определяют концентрацию раствора КОН: | |
| А | алкалиметрией | |
| В | ацидиметрией | |
| С | методом осаждения | |
| D | оксидиметрией | |
| 17. | Для определения кислотности желудочного сока в качестве титранта следует применить: | |
| А | I2 | |
| В | KI | |
| С | KOH | |
| D | НСl | |
| 18. | Метод анализа, к которому относится титрование по реакции: AgNO3 + NaCl = AgCl↓ + NaNO3 | |
| А | Осадительное титрование | |
| В | Кислотно-основное титрование | |
| С | Комплексонометрия | |
| D | Оксидиметрия | |
| 19. | Объем рабочего раствора, потраченного на реакцию с исследуемым раствором, определяют с помощью: | |
| А | пипетки | |
| В | бюретки | |
| С | мерного цилиндра | |
| D | мерной колбы | |
| 20. | Какие вещества используются в методе нейтрализации в качестве исходных? | |
| А | NaOH, HCl | |
| В | Na2CO3, HCl | |
| С | NH3, H2O | |
| D | BaCl2, H2SO4 |
5. Ситуационные задачи:
| № | Текст задания: |
| 1. | Написать уравнения качественных реакций на ионы меди и хлора в растворе CuCl2 и определить признаки их прохождения. |
| 2. | Для титрования 10 мл анализируемого раствора гидроксида калия методом ацидиметрии израсходовано 16 мл раствора серной кислоты, с молярной концентрацией эквивалента 0,05 н. Рассчитать молярную концентрацию эквивалента гидроксида калия. |
| 3. | На титрование 25 мл раствора FeSO4 в кислой среде израсходовано 12,5 мл раствора КМnО4 с Сf(КМnО4) = 0,01 моль/л. Рассчитать массу FeSO4 в растворе. |
| № | Эталоны ответов: |
| 1. | Качественная реакция на ион Cu2+: CuCl2 + 2NaOH → Cu(OH)2¯ + 2NaCl (молекулярное уравнение) голубой Cu2+ + 2Cl- + 2Na+ + 2OH- → Cu(OH)2¯ + 2Na+ + 2Cl- (полное ионное уравнение) Cu2+ + 2OH- → Cu(OH)2¯ (сокращенное ионное уравнение) Качественная реакция на ион Cl-: CuCl2 + 2AgNO3 → 2AgCl¯ + Cu(NO3)2 (молекулярное уравнение) белый Cu2+ + 2Cl- + 2Ag+ + 2NO3- → 2AgCl¯ + Cu2+ + 2NO3- (полное ионное уравнение) Cl- + Ag+ → AgCl¯ сокращенное ионное уравнение) |
| 2. |  Þ Þ 
|
| 3. | Находим Сf раствора FeSO4 Þ 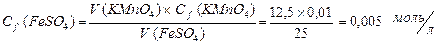 Массу FeSO4 находим по формуле:
Массу FeSO4 находим по формуле: 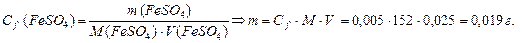
|
6. Задачи для самостоятельного решения (выполнить письменно):
| 1. | Написать уравнения качественных реакций на ион аммония и карбонат-ион в растворе (NH4)2СO3 и определить признаки их прохождения. | |
| 2. | На титрование 50 мл раствора NaOН затрачено 35 мл раствора HCl с Сf(HCl) = 0,5 моль/л. Рассчитать массу NaОН в растворе. | |
| 3. | На титрование 20 мл анализируемого раствора уксусной кислоты методом алкалиметрии израсходовано 25 мл раствора гидроксида натрия, с молярной концентрацией эквивалента 0,05 моль/л. Рассчитать молярную концентрацию эквивалента уксусной кислоты в растворе. |
7. Вспомогательные материалы по самоподготовке:
Аналитическая химия – наука о методах и приемах определения качественного и количественного химического состава веществ или их смесей.
АНАЛИТИЧЕСКАЯ ХИМИЯ
| Качественный анализ | Количественный анализ |
| определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе, смеси веществ. | определение количественного состава вещества т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе, смеси веществ. |
Качественный анализ
| Систематический (разделение смеси ионов на аналитические группы катионов и анионов) | Дробный (открытие каждого иона без предварительного разделения на ионы) |
 2020-10-10
2020-10-10 464
464








