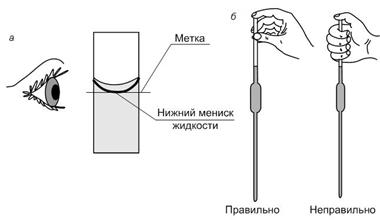
Для правильного измерения объема жидкости мерную посуду наполняют ею так, чтобы мениск касался метки, при этом глаз должен находиться на уровне метки. Уровень смачивающих стекло прозрачных жидкостей (воды, водных растворов, спирта) устанавливают по нижнему краю вогнутого мениска, а для непрозрачных и темноокрашенных – по верхнему краю.
Лабораторная работа: “Физико-химические методы исследования растворов.
Приготовление растворов”.
Ход работы:
Приготовить 1% и 2% растворы хлорида натрия массой 250 грамм, используя готовые навески. С помощью ареометра определить плотность приготовленного раствора и установить ω% по справочной таблице. С помощью рефрактометра определить коэффициент рефракции полученного раствора и установить ω% его раствора по таблице. Сравнить полученные результаты.
Таблица 1. Зависимость показателя преломления (n) и плотности раствора (r)
| Плотность, | Концентрация | Коэффициент рефракции | |
| г/мл | ω % | С | (n) |
| 1.00 | 0 | 0 | 1.333 |
| 1.007 | 1 | 0.17 | 1.335 |
| 1.015 | 2 | 0.34 | 1.337 |
| 1.022 | 3 | 0.51 | 1.338 |
| 1.029 | 4 | 0.70 | 1.340 |
| 1.036 | 5 | 0.85 | 1.342 |
| 1.044 | 6 | 1.07 | 1.343 |
| 1.051 | 7 | 1.26 | 1.345 |
| 1.058 | 8 | 1.45 | 1.347 |
| 1.066 | 9 | 1.64 | 1.348 |
| 1.073 | 10 | 1.83 | 1.350 |
| 1.080 | 11 | 2.03 | 1.352 |
От концентрации натрия хлорида (при 20 С)
Работа с рефрактометром.
Одну или две капли исследуемого раствора соли, помещают между призмами рефрактометра. В окно верхней призмы направляют источник света. Через нижнюю призму свет попадает на шкалу прибора, частично её освещая и создавая чёткую границу света снизу и тени сверху. Если граница светотени недостаточно чёткая, имеет радужные полоски, то вращением компенсатора добиваются их исчезновения. Поворотом рычага, на котором закреплён окуляр, добиваются совмещения трёх чёрточек с границей светотени и считывают по левой шкале коэффициент рефракции, по правой - процентное содержание вещества. Контроль работы производится по дистиллированной воде, коэффициент рефракции которой равен 1,333. Зная коэффициент рефракции раствора, по таблице находят его процентное содержание. Необходимо помнить, что таблица составляется только для определенного вещества.
Вывод:
Занятие № 2. Тема: «Основы химического анализа. Качественный и количественный анализ. Основы титриметрического анализа. Метод кислотно-основного титрования. Алкалиметрия».
1. Актуальность темы:
Аналитическая химия - наука, предметом которой является разработка методов определения качественного и количественного состава веществ, встречаемых в природе и входящих в организм человека и всего живого.
Научные исследования и практика показали необходимость проведения качественного и количественного анализа веществ и их смесей. На основании анализа мочи, крови, желудочного сока можно получить данные, которые облегчают распознать заболевание, дают возможность следить за течением болезни. При помощи качественного и количественного анализа разрешается вопрос о пригодности медицинских препаратов для лечебных целей.
Без знания состава живого организма невозможно понять сущность процессов, которые протекают в нем и невозможно разработать методы лечения. Диагностика заболевания основана на сравнении результатов анализа больного с нормальным содержанием отдельных компонентов в крови, моче, желудочном соке и других жидкостях.
2. Цель обучения:
Знать основы качественного и количественного анализа, овладеть техникой выполнения метода алкалиметрии при определении кислотности растворов и желудочного сока, экспериментально проводить качественный анализ некоторых веществ и ионов.
 2020-10-10
2020-10-10 376
376








