1. Актуальность темы:
Поддержание кислотно-основного и электролитного равновесия в тканях, биологических жидкостях крайне важно для нормального функционирования организма. Изменение электролитного состава приводит к изменению реакции среды биологических жидкостей. Во-первых, ионы Н+ оказывают каталитическое действие на многие биохимические превращения. Во-вторых, ферменты и гормоны проявляют биологическую активность только в строго определенном интервале значений рН (например, фермент пепсин, участвующий в расщеплении пищи в желудке, активен только при рН = 1,5). В-третьих, даже небольшие изменения концентрации ионов Н+ ощутимо влияют на величину осмотического давления в этих жидкостях. Поддержание постоянного рН в крови и тканевых жидкостях регулируется с помощью нескольких буферных систем. Одним из способов диагностики заболеваний является определение рН желудочного сока, крови, мочи.
2. Цель обучения:
Знать основные положения теории электролитической диссоциации; понятие о сильных и слабых электролитах; понятие о буферных растворах; механизм действия буферных растворов; буферные системы организма. Уметь решать расчетные задачи по вычислению концентрации ионов водорода и рН растворов сильных и слабых электролитов; решать расчетные задачи на вычисление рН буферных растворов; буферной ёмкости.
1. Диссоциация воды. Ионное произведение воды.
2. Водородный показатель. Шкала рН. рН биологических жидкостей. Ацидоз, алкалоз.
3. Теория кислот и оснований Аррениуса, Бренстеда-Лоури, Льюиса.
4. Типы протолитических реакций: нейтрализации, гидролиза, ионизации.
5. Гидролиз солей, типы гидролиза. Степень и константа гидролиза. Факторы, влияющие на степень гидролиза.
6. Роль гидролиза в биохимических процессах.
7. Буферные растворы. Классификация и химический состав.
8. Механизм буферного действия (гидрокарбонатного, фосфатного, ацетатного, аммиачного).
9. Расчёт pH буферных растворов. Уравнения Гендерсона–Хассельбаха для кислотного и основного буферных растворов.
10. Буферная ёмкость. Определение. Формулы для расчёта. Факторы, влияющие на буферную ёмкость.
11. Буферные системы крови. Понятие о кислотно-основном равновесии.
| № задачи | Текст задания: |
| 1. | Рассчитать [H+] и рН раствора гидроксида натрия, С=0,1 моль/л, α=100% |
| 2. | Рассчитать [H+] и рН раствора уксусной кислоты, С=0,01 моль/л, α=0,042 |
| 3. | Степень диссоциации слабой одноосновной кислоты в 0,2 М растворе равна 0,03. Вычислить значение [H+], [ОH-] и рОН для этого раствора. |
| 4. | Вычислить pH буферного раствора, приготовленного из 200 мл раствора CH3COOH (с=0,1 моль/л) и 100 мл CH3COONa (c=0,2 моль/л). Как изменится pH этого раствора при добавлении к нему 10 мл раствора NaOH (с=0,1моль/л) и при разбавлении в 15 раз? |
| 5. | Рассчитать pH буферного раствора, приготовленного из 200 мл раствора NH4Cl (c=0,1 моль/л) и 150 мл NH3•H2O (c=0,25 моль/л) |
| 6. | К 100 мл крови добавили 25 мл раствора HCl (c=0,05моль/л), при этом значение pH изменилось от 7,36 до 6,9. Рассчитать буферную ёмкость крови по кислоте. |
| 4. | Вычислить pKa молочной кислоты, если pH раствора в 1 литре которого содержится 0,01 моль молочной кислоты и 0,0139 моль лактат-иона (анион молочной кислоты) равен 4,0. |
| № задачи | Эталоны ответов: |
| 1. | NaOH → Na+ + OH- [OH-] = C ∙ α = 0.1моль-ион/л [Н+] = 10-14 = 10-13 рН= -lg10-13 = 13 10-1 |
| 2. | CH3COOH → H+ + CH3COO- [H+] = C ∙ α = 0.01 ∙ 0.042 = 4.2 ∙ 10-4 pH = -lg 4.2 ∙ 10-4 = 4 – lg4.2 = 3.38 |
| 3. | HA → H+ + A- [H+] = C ∙ α; [H+] = 0.2 ∙ 0.03 = 6 ∙ 10-3 [OH-] = 1∙10-14 = 1.7∙10-12 pOH = -lg 1.7∙10-12 = 12-lg1.7 = 11.78 6∙10-3 |
| 4. | А) 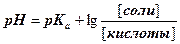 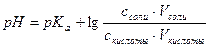 ; ; 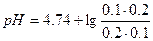 =4.74 б) При добавлении раствора NaOH: =4.74 б) При добавлении раствора NaOH: 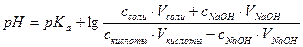 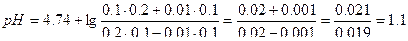 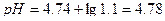 Изменение pH составляет 4.78-4.74=0.04 В) При разбавлении в 15 раз: Изменение pH составляет 4.78-4.74=0.04 В) При разбавлении в 15 раз: 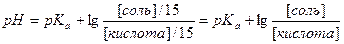 При разбавлении буферного раствора pH не изменется. При разбавлении буферного раствора pH не изменется. |
| 5. |  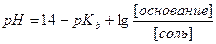 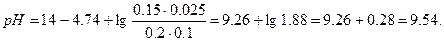 |
| 6. | 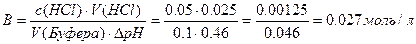 |
| 7. | В соответствии с уравнением Гендерсона-Хассельбальха: 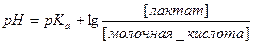  |
1. Выполнить тестовые задания (письменно):
| 1. | По протолитической теории Аррениуса основания - это электролиты, диссоциирующие в растворе с образованием ионов: | |
| A | HCOO– | |
| B | ОН- | |
| C | СО32- | |
| D | Н+ | |
| 2. | По протолитической теории Аррениуса кислоты - это электролиты, диссоциирующие в растворе с образованием ионов: | |
| A | Н+ | |
| B | К+ | |
| C | Na+ | |
| D | ОН- | |
| 3. | Выделите электролиты: | |
| A | сера, сахар | |
| B | бензол, этилен | |
| C | ацетат Na, циановодородная кислота | |
| D | вода, глюкоза | |
| 4. | Ионная сила плазмы крови человека равна 0,15 М; заменителем плазмы крови является: | |
| A | 0,7 м раствор глюкозы | |
| B | 0,15 м раствор карбоната натрия | |
| C | 0,9% раствор хлорида натрия | |
| D | 9% раствор хлорида натрия | |
| 5. | Водородный показатель рН характеризует: | |
| A | кислотность | |
| B | ионную силу | |
| C | образование осадка | |
| D | вязкость | |
| 6. | Если рН раствора равен 8, то концентрация ионов ОН– равна: | |
| A | lg 10-8 | |
| B | 10-6 | |
| C | 10-8 | |
| D | 10-2 | |
| 7. | рН 0,0001 н раствора КОН равен: | |
| A | 12 | |
| B | 10 | |
| C | 11 | |
| D | 4 | |
| 8. | При приеме внутрь раствора гидрокарбоната натрия рН желудочного сока: | |
| A | уменьшается | |
| B | увеличивается | |
| C | не изменяется | |
| 9. | рН раствора при равных концентрациях больше у: | |
| A | HCN | |
| B | NaOH | |
| C | NH4OH | |
| D | НСl | |
| 10. | Процесс гидролиза – это: | |
| A | растворение соли в воде | |
| B | распад вещества на ионы | |
| C | взаимодействие ионов соли с составными частями воды | |
| 11. | Следствием гидролиза является: | |
| A | разбавление раствора | |
| B | изменение активной концентрации ионов соли | |
| C | образование слабого электролита (электролитов) | |
| D | накопление ионов Н+ или ОН– в растворе | |
| 12. | Гидролизу соли, образованной слабой кислотой и сильным основанием, соответствует уравнение: | |
| A | СН3СОО– + Н2О = СН3СООН + ОН– | |
| B | NH4+ + H2O = NH4OH + H+ | |
| C | NH4+ + CH3COO– + H2O = NH4OH + CH3COOH | |
| D | Al3+ + H2O = AlOH2+ + H+ | |
| 13. | Гидролизу соли, образованной сильной кислотой и слабым основанием, соответствует уравнению: | |
| A | HCOO– + HOH = OH– + HCOOH | |
| B | NH4+ + HOH = H+ + NH4OH | |
| C | Al3+ + CH3COO– + HOH = AlOH2+ + CH3COOH | |
| D | NH4+ + CN– + HOH = NH4OH + HCN | |
| 14. | Гидролиз АТФ в организме – источник: | |
| A | ионов водорода | |
| B | воды | |
| C | белков | |
| D | энергии | |
| 15. | Буферные растворы – это система: | |
| A | поддерживающая постоянство рН при добавлении небольших количеств кислот, щелочей, при разбавлении | |
| B | изменяющая рН при добавлении сильных кислот, щелочей | |
| C | изменяющая рН при разбавлении | |
| D | не изменяющая рН при добавлении больших количеств сильных кислот, щелочей | |
| 16. | Выбрать из предлагаемых веществ возможные компоненты для приготовления буферных растворов: | |
| A | NaCl, HHb, NaHb, HCl | |
| B | NaHCO3, CO2∙H2O, NaH2PO4, Na2HPO4 | |
| C | NaHCO3, CO2∙H2O, Na2SO4, H2SO4 | |
| D | СН3СООNa, СН3СООН, NH4OH, NH4Cl | |
| 17. | От каких факторов зависит pH буферного раствора? | |
| A | От концентрации компонентов | |
| B | От соотношения концентрации компонентов | |
| C | От константы диссоциации слабого электролита | |
| D | От константы гидролиза соли | |
| 18. | рН крови в норме: | |
| A | 1. 6,80-6,90 | |
| B | 2. 7,90-8,02 | |
| C | 7,36-7,42 | |
| D | 7,42-7,50 | |
| 19. | Тяжелые формы сахарного диабета сопровождаются нарушением кислотно-основного равновесия в организме и возникновением ацидоза. Какое значение рН крови этому соответствует? | |
| A | 7,7 – 7,9 | |
| B | 7,1 – 7,2 | |
| C | 7,35 – 7,65 | |
| D | 7,85 – 8,15 | |
| 20. | Какой буферный раствор имеет наибольшее содержание в крови человека? | |
| A | Аммиачный | |
| B | Фосфатный | |
| C | Гемоглобиновый | |
| D | Гидрокарбонатный |
6. Задачи для самостоятельного решения (выполнить письменно):
| 1. | Изобразить схемы гидролиза (в молекулярном, ионном и сокращенном ионном виде) следующих солей, указать характер среды в растворе: а) К2SО3 б) NH4CН3СОО | |
| 2. | Рассчитать рН желудочного сока, если массовая доля соляной кислоты в желудочном соке равна 0,45%. | |
| 3. | Определить pH раствора, в 1л которого содержится 0,1 г NaOH, α=100%. | |
| 4. | Определите рН кишечного сока, если концентрация ОН- в составе кишечного сока составляет 2,3·10-6 моль/л. | |
| 5. | Рассчитать рН оксалатной буферной системы, состоящей из100 мл раствора щавелевой кислоты с концентрацией С(Н2С2О4) = 0,5 моль/л и 150 мл раствора оксалата натрия с концентрацией С(Na2C2O4) = 0,25 моль/л, если КД (Н2С2О4) = 5,6·10-2. | |
| 6. | Рассчитайте объемы (мл) 0,1 М СН3СООН и 0,1 М СН3СООNa, необходимые для приготовления 100 мл буферного раствора с рН = 4,0. рК (СН3СООН) = 4,76. | |
| 7. | К 10 мл сыворотки крови с рН = 7,34 прибавили 1 мл раствора хлороводородной кислоты с С(НСl) = 0,05 моль/л, что привело к снижению рН до 7,29. Определить буферную емкость крови по кислоте. |
7. Вспомогательные материалы по самоподготовке:
Приложение 1
| Таблица трехзначных десятичных логарифмов | ||||||||||
| 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 1 | 000 | 041 | 079 | 114 | 146 | 176 | 204 | 230 | 225 | 279 |
| 2 | 301 | 322 | 342 | 362 | 380 | 398 | 415 | 431 | 447 | 464 |
| 3 | 477 | 491 | 505 | 519 | 532 | 544 | 556 | 568 | 580 | 591 |
| 4 | 602 | 613 | 623 | 634 | 644 | 653 | 669 | 672 | 681 | 690 |
| 5 | 699 | 708 | 716 | 724 | 732 | 740 | 748 | 756 | 763 | 771 |
| 6 | 778 | 785 | 792 | 799 | 806 | 813 | 820 | 826 | 833 | 839 |
| 7 | 845 | 851 | 857 | 863 | 869 | 875 | 881 | 887 | 892 | 898 |
| 8 | 903 | 909 | 914 | 919 | 924 | 929 | 965 | 940 | 945 | 949 |
| 9 | 954 | 959 | 964 | 969 | 973 | 978 | 982 | 987 | 991 | 996 |
Пример расчета pH по [H+]: [H+]=5.3∙10-1 моль/литр
pH=-lg[H+]=-lg5,310-1=-(0.724-1)=-(-0.276)=0.28
Приложение 2
| Значение pH различных биологических жидкостей, тканей тела человека и других жидкостей
| ||
| 1. | Двенадцатиперстная кишка | 7,0 – 7,8 |
| 2. | Желудочный сок | 1,6 – 1,8 |
| 3. | Кровь человека | 7,35 – 7,45 |
| 4. | Моча | 4,8 – 7,5 |
| 5. | Мышечная ткань | 6,7 – 6,8 |
| 6. | Панкреатический сок | 8,3 |
| 7. | Пот | 4,0 – 8,0 |
| 8. | Почки | 6,6 – 6,9 |
| 9. | Протоплазма клеток | 6,4 – 7,0 |
| 10. | Связки | 7,2 |
| 11. | Слёзы | 7,4 |
| 12. | Слюна | 6,35 – 6,85 |
| 13. | Тонкая кишка | 6,2 – 7,3 |
| 14. | Молоко | 6,6 – 6,9 |
| 15. | Морская вода | 8,0 |
| 16. | Белок куриного яйца | 8,0 |
| 17. | Апельсиновый сок | 2,6 – 4,4 |
| 18. | Томатный сок | 4,3 |
| 19. | Кофе | 5,0 |
| 20. | Чай | 5,5 |
 2020-10-10
2020-10-10 1349
1349
