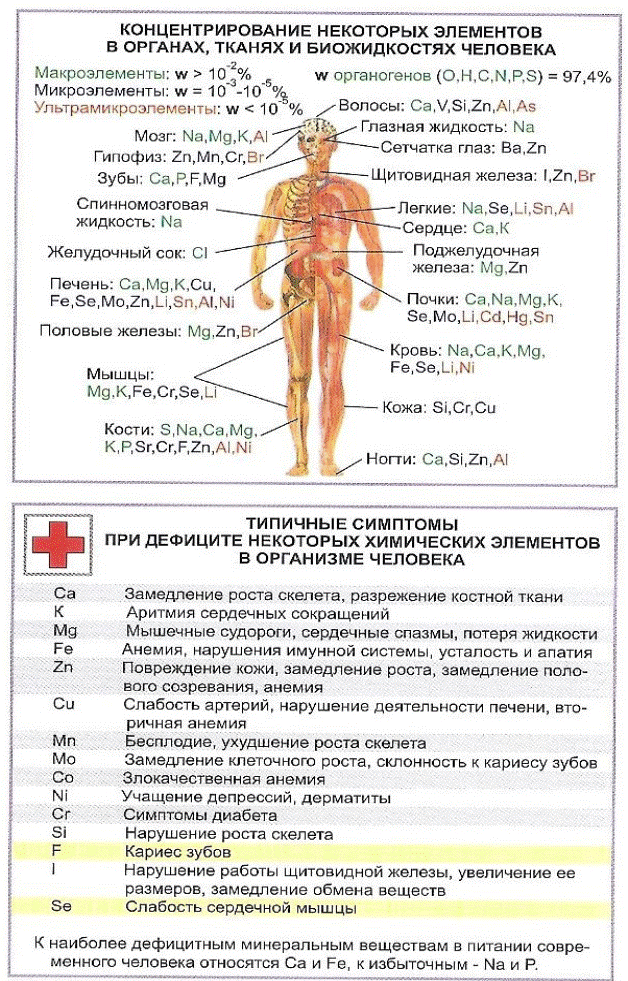
4.2. Номенклатура комплексных соединений. Названия комплексных соединений (солей) образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже.
Название комплексного катиона составляют следующим образом:
А. Сначала указывают числа (используя греческие числительные) и названия анионных (отрицательно заряженных) лигандов с окончанием «о».
Греческие числительные: моно-, ди-, три-, тетра-, пента-, гекса-, гепта-, окта- и т.д.
Названия анионныхлигандов:
| Сl– | CN– | SО32– | SО42– | ОН– | NО2– | СNS– | СО32– | |
| хлоро | циано | сульфито | сульфато | гидроксо | нитро | родано | карбонато |
Б. Затем называют числа и названия нейтральных лигандов:
| Н2О | NН3 | СО | NO |
| аква | аммин | карбонил | нитрозил |
В. Последним называется комплексообразователь в родительном падеже с указанием степени его окисления (в скобках римскими цифрами после названия комплексообразователя).
Например: [Pt(NH3)3Cl]Cl – хлорид хлоротриамминплатины (II).
Если металл образует ион с одной степенью окисления, то она в название комплекса может не входить. Например, [Zn(NH3)4]Cl2 – дихлорид тетраамминцинка.
Название комплексного аниона
образуется аналогичным образом, с добавлением суффикса «ат» к корню латинского названия комплексообразователя (например, феррат, никелат, хромат, кобальтат, купрат и т.д.).
Например: K2[PtCl6] – гексахлороплатинат (IV) калия; Ba[Cr(NH3)2(SCN)4]2 – тетрароданодиамминхромат (III) бария; K3[Fe(CN)6] – гексацианоферрат (III) калия; K2[BeF4] – тетрафторобериллат калия.
Названия нейтральных комплексных частиц
образуются так же, как и катионов, но комплексообразователь называют в именительном падеже, а степень его окисления не указывают, т.к. она определяется электронейтральностью комплекса.
Например: [Pt(NH3)2Cl2] – дихлородиамминплатина;[Ni(CO)4] – тетракарбонилникель.
4.2. Ситуационные задачи:
| № задачи | Текст задания: |
| 1. | Назвать комплексные соединения, определить координационное число центрального атома, написать уравнения диссоциации и выражения для констант нестойкости. а) Na[Co(NH3)2ClBr3] б) [Ni(H2O)4SO4] в) Ca[Fe(H2O)(CN)5] г) [Fe(NH3)(CO)4Cl]SO4 |
| 2. | Написать схемы диссоциации КС и выражения для констант нестойкости: а) Na4[Fe(CN)6], б) [Ag(NH3)2]Cl. Найти численные значения КН по табличным данным и указать какой из комплексных ионов более устойчив. |
| № задачи | Эталоны ответов: |
| 1. | а) Na[Co(NH3)2ClBr3] – трибромохлородиамминкобальтат (III) натрия, кч =6
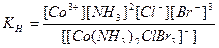 б) [Ni(H2O)4SO4] – сульфатотетраакваникель (II), кч = 6
б) [Ni(H2O)4SO4] – сульфатотетраакваникель (II), кч = 6
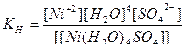 в) Ca[Fe(H2O)(CN)5] – пентацианоакваферрат (III) кальция, кч = 6
в) Ca[Fe(H2O)(CN)5] – пентацианоакваферрат (III) кальция, кч = 6
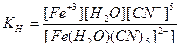 г) [Fe(NH3)(CO)4Cl]SO4 - сульфат хлороамминпентакарбонилжелеза (III), кч = 6
г) [Fe(NH3)(CO)4Cl]SO4 - сульфат хлороамминпентакарбонилжелеза (III), кч = 6
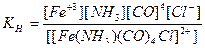
|
| 2. | а) Na4[Fe(CN)6] «4Na+ + [Fe(CN)6]4-
[Fe(CN)6]4- «Fe2+ + 6CN-, КН = 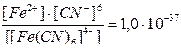 б) [Ag(NH3)2]Cl «[Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ «Ag+ + 2NH3, КН =
б) [Ag(NH3)2]Cl «[Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ «Ag+ + 2NH3, КН = 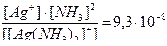 Наиболее устойчив комплексный ион [Fe(CN)6]4-, так как имеет меньшее значение КН.
Наиболее устойчив комплексный ион [Fe(CN)6]4-, так как имеет меньшее значение КН.
|
4.3. Константы нестойкости комплексных ионов в водных растворах при 25°С
| Уравнение диссоциации | Константа нестойкости | Уравнение диссоциации | Константа нестойкости |
| [Ag(NH3)2]+ «Ag+ + 2NH3 | 9.3´10-8 | [Cu(NH3)4]+2 «Cu2+ + 4NH3 | 2.1´10-13 |
| [Ag(NO2)2]- «Ag+ + 2NO2- | 1.8´10-3 | [Cu(CN)4]-3 «Cu+ + 4CN- | 5.0´10-31 |
| [Ag(S2O3)2]- «Ag+ + 2 S2O3- | 1.1´10-13 | [Fe(CN)6]-4 «Fe2+ + 6CN- | 1.0´10-37 |
| [Ag(CN)2]- «Ag+ + 2CN- | 1.1´10-23 | [Fe(CN)6]-3 «Fe3+ + 6CN- | 1.0´10-42 |
| [HgCl4]-2 «Hg2+ + 4Cl- | 8.5´10-16 | [Ni(NH3)4]+2 «Ni2+ + 4NH3 | 3.4´10-8 |
| [HgBr4]-2 «Hg2+ + 4Br- | 1.0´10-21 | [Ni(CN)4]-2 «Ni2+ + 4CN- | 1.0´10-31 |
| [HgI4]-2 «Hg2+ + 4I- | 1.5´10-30 | [Co(NH3)6]+3 «Co3+ + 6NH3 | 6.2´10-36 |
| [Hg(CN)4]-2 «Hg2+ + 4CN- | 4.0´10-42 | [Co(NH3)6]+2 «Co2+ + 6NH3 | 8.5´10-6 |
| [Cd(NH3)4]+2 «Cd2+ + 4NH3 | 7.6´10-8 | [Co(CN)6]-4 «Co2+ + 6CN- | 8.1´10-20 |
| [Cd(CN)4]-2 «Cd2+ + 4CN- | 7.8´10-18 | [Co(NH3)4]+2 «Co2+ + 4NH3 | 4.1´10-5 |
5. Выполнить тестовые задания (письменно):
| 1. | Какие химические свойства обуславливают использование KMnO4 в медицине как антисептика? | ||
| А | способность к полной диссоциации на ионы | ||
| В | отсутствие гидролиза | ||
| С | восстанавливающие свойства | ||
| D | окислительные свойства | ||
| 2. | Какой элемент входит в состав основных антиоксидантных соединений и усиливает иммунную защиту? | ||
| А | Co | ||
| В | Se | ||
| С | Zn | ||
| D | Cr | ||
| 3. | При недостатке этого элемента развивается синдром нарушения толерантности к глюкозе, сопутствующего сахарному диабету: | ||
| А | Со2+ | ||
| В | Са2+ | ||
| С | Сr2+ | ||
| D | Ni2+ | ||
| 4. | Недостаток ионов Са в организме при нарушении кальциевого обмена в организме человека приводит к развитию: | ||
| А | дисбактериоза | ||
| В | диабета | ||
| С | рахита | ||
| D | анемии | ||
| 5. | Обмен этого элемента тесно связан с обменом кальция. Он является основой скелета человека и животных, зубов. Это элемент: | ||
| А | N | ||
| В | P | ||
| С | O | ||
| К | |||
| 6. | При недостатке этого элемента развивается злокачественная анемия (анемия Аддисон-Бирмера): | ||
| А | Cu2+ | ||
| В | Са2+ | ||
| С | Сr2+ | ||
| D | Со2+ | ||
| 7. | Какой из ионов вызывает торможение центральной нервной системы: | ||
| А | I- | ||
| В | Br - | ||
| С | F- | ||
| D | Мо2+ | ||
| 8. | Недостаток иона железа (II) в организме приводит к развитию: | ||
| А | дисбактериоза | ||
| В | диабета | ||
| С | рахита | ||
| D | анемии | ||
| 9. | Порошок этого вещества применяется наружно в виде мазей и присыпок, при лечении кожных заболеваний (себорреи). Он входит в состав аминокислоты цистеин. Это: | ||
| А | N | ||
| В | S | ||
| С | C | ||
| D | К | ||
| 10. | Ион, принимающий участие в построении эпителиальной и соединительной тканей: | ||
| А | Са2+ | ||
| В | Аl3+ | ||
| С | Zn2+ | ||
| D | Fe3+ | ||
| 11. | Центральный ион – комплексообразователь молекулы хлорофилла: | ||
| А | Cu2+ | ||
| В | Ca2+ | ||
| С | Mg2+ | ||
| D | Zn2+ | ||
| 12. | Концентрация этого элемента в организме в организме человека около 10%, в земной коре – 1%. Он связующий элемент между цепями ДНК и вторичной структуры белков: | ||
| А | S | ||
| В | H | ||
| С | N | ||
| D | О | ||
| 13. | Ионы этого элемента в зависимости от концентрации, блокируют или обеспечивают нервно-мышечную передачу, они угнетают центр дыхания, а также сосудодвигательный центр, благодаря чему снижают артериальное давление. Это - ион: | ||
| А | Co2+ | ||
| В | Mg2+ | ||
| С | P5+ | ||
| D | Na+ | ||
| 14. | Ион какого элемента, участвует в биосинтезе половых гормонов (тестостерона) и регулирует функцию половых желез: | ||
| А | I- | ||
| В | Сl- | ||
| С | Br- | ||
| D | F- | ||
| 15. | Для нормального процесса кроветворения необходимо присутствие трех элементов: | ||
| А | Fe, Zn, Co | ||
| В | Co, Fe, Cr | ||
| С | Fe, Co, Cu | ||
| D | Cu, Mo, Fe | ||
| 16. | Питьевая сода (NaHCO3) используется для полоскания горла в виде 2% раствора. Сколько грамм соды нужно растворить в стакане воды (200 мл) для приготовления данного раствора. | ||
| А | 4,0 г. | ||
| В | 4,1 г. | ||
| С | 2 г. | ||
| D | 20 г. | ||
| 17. | Какой ион принимает участие в процессе переноса кислорода к органам и тканям? | ||
| А | Cr3+ | ||
| В | Fe3+ | ||
| С | Cd2+ | ||
| D | Fe2+ | ||
| 18. | Какой из катионов является комплексообразователем в молекуле гемоглобина? | ||
| А | Fe3+ | ||
| В | Co3+ | ||
| С | Hg2+ | ||
| D | Fe2+ | ||
| 19. | Заболевание “Эндемический зоб” наблюдается при недостатке в организме элемента: | ||
| А | Br | ||
| В | I | ||
| С | Cl | ||
| D | F | ||
| 20. | Какой из катионов является комплексообразователем в молекуле витамина В12? | ||
| А | Fe3+ | ||
| В | Co2+ | ||
| С | Mg2+ | ||
| D | Zn2+ |
6. Задания для самостоятельного решения (выполнить письменно):
| 1. | Определить степень окисления центрального атома в комплексных соединениях, назвать их: | а) [Co(NH3)5Cl](OH)2 –
б) [Cr(H2O)3PO4] –
в) K3[Cr(OH)6] –
г) Na3[Fe(CN)5H2O] –
| |
| 2. | Составить молекулярную формулу КС по названию: | а) хлорид гексааквахрома (III) –
б) бромид нитропентаамминкобальта (III) –
в) нитрат дихлороакватриамминкобальта (III) –
г) гидроксопентахлоропалладат (IV) аммония – | |
| 3. | Написать схему диссоциации и выражение Кн для комплексных соединений: | а) [Cr(H2O)4Br2]Cl
б) К2[Fe(SCN)5H2O] | |
| 4. | Из раствора комплексной соли суммарного состава FeBr3´×5H2О нитрат серебра осаждает только 2/3 содержащегося в ней брома. В растворе соли не обнаружено ионов железа. Измерение электропроводности раствора показывает, что соль по первой ступени распадается на три иона. Каково координационное строение этого соединения? Назвать и написать уравнение диссоциации комплексной соли и выражение константы нестойкости.
| ||
 2020-10-10
2020-10-10 371
371








