Дополните:
1. Моляльная концентрация раствора (Смоляльная) показывает ______________
2. Закон эквивалентов имеет следующее математическое выражение ______
3. Насыщенный пар – это ___________________________________________
4. Давление насыщенного пара над чистым растворителем (ро) больше, чем давление растворителя над раствором неэлектролита (р1), так, как: 1) _________
2) _________
5. Электролиты – это __________________________________________________
6. Кислые, основные и комплексные соли диссоциируют ___________________
7. Гидролиз соли протекает по катиону, если соль образована _____, рН = ____
8. Раствор гидроксида бария имеет рН = 12. Концентрация основания в растворе при 100 % диссоциации равна ________________________ моль/л
9. Окислитель в ходе реакции ____________________, поэтому его алгебраическая величина степени окисления ___________________________
10. В кислой среде: а) избыток кислорода в частице связываем ______________ с образованием _____________________________________
б) недостаток кислорода в частице берём из ____________ с образованием _________________________________________
Укажите номер правильного ответа:
11. Объём 0,1Н раствора КОН, необходимый для нейтрализации 20 мл 0,15Н раствора азотной кислоты, равен __________________________________ мл
1) 30 2) 25 3) 50 4) 40
12. При температуре 20оС давление насыщенного пара бензола равно 100 кПа. Давление насыщенного пара над раствором бензола (М = 78 г/моль) в 83 г которого содержится 12,8 нафталина (М = 128 г/моль) составляет ______ кПа
1) 100 2) 99 3) 90 4) 80
13. Диссоциация по трём ступеням возможна в растворе:
1) гидроксида алюминия 3) нитрата алюминия
2) хлорида алюминия 4) ортофосфата калия
14. Наиболее слабым электролитом является:
1) HF 2) HCl 3) HBr 4) HI
15. Уравнение реакции практически осуществимой в водном растворе имеет вид
1) CuSO4 + 2KOH → K2SO4 + Cu(OH)2
2) Fe2(SO4)3 + 6HNO3 → 2Fe(NO3)3 + 3H2SO4
3) NaNO3 + HCl → NaCl + HNO3
4) Ba(NO3)2 + 2NaOH → 2NaNO3 + Ba(OH)2
16. Одним из продуктов гидролиза нитрата железа (ΙΙΙ) по второй ступени является
1) Fe(OH)2NO3 3) FeOH(NO3)2
2) FeOH(NO3) 4) Fe(OH)3
17. Метилоранж желтый при растворении в воде каждой из двух солей
1) K2SO3 и Na3PO4 3) ZnCl2 и CuSO4
2) CaCl2 и FeCl3 4) Mn(NO3)2 и NaCl
18. В уравнении для расчета константы гидролиза хлорида аммония не учитывается значение концентраций
1)  2)
2) 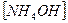 3)
3)  4)
4) 
19. Только восстановительные свойства проявляют вещества
1) KIO3 2) KIO2 3) KI 4) I2
20. Окислительно-восстановительную двойственность проявляют (два варианта ответа)
1) N2 2) NH3 3) NaNO2 4) NaNO3
 2020-10-10
2020-10-10 196
196








