Дополните:
1. Молярная концентрация раствора (См) показывает _____________________
2. Эквивалент металла рассчитывают по формуле Эме = ___________________
3. Процесс испарения любой жидкости протекает с ________________ тепла
4. Понижение температуры замерзания раствора от концентрации растворенного вещества отражает закон __________ и имеет математическое выражение ____________________________, где ________________________
5. Электролитическая диссоциация – это _______________________________
6. Закон разбавления Оствальда устанавливает зависимость между __________ и имеет следующее математическое выражение ___________________________
7. Гидролиз соли протекает по аниону, если соль образована _____ рН = ___
8. Раствор, в 500 мл которого растворено 1,825 г HCl, имеет рН, равный ___
9. ЭДС рассчитывают по формуле _________________________________
10. В щелочной среде: а) недостаток кислорода в частице берём из _____ с образованием ______________________________________________
б) избыток кислорода в частице связываем _______ с образованием ______________________________________________________
Укажите номер правильного ответа:
11. Объём 0,1Н раствора NaOH, необходимый для нейтрализации 20 мл 0,2Н раствора хлороводородной кислоты равен __________________________ мл
1) 40 2) 35 3) 30 4) 20
12. Осмотическое давление раствора, содержащего 0,2 г растворенного вещества в 300 мл раствора при 27оС равно 27,7 кПа. Молярная масса растворенного вещества равна _____________________
1) 60 2) 30 3) 90 4) 66
13. Диссоциация по трём ступеням возможна в растворе:
1) хлорида алюминия 3) нитрата алюминия
2) ортофосфата калия 4) ортофосфорной кислоты
14. К сильным электролитам относятся (несколько вариантов ответа):
1) PbI2 2) H2CO3 3) NaOH 4) Al2(SO4)3
15. Уравнение реакции практически осуществимой в водном растворе имеет вид
1) Ba(NO3)2 + K2SO4 → BaSO4 + 2KNO3
2) BaCl2 + 2KOH → Ba(OH)2 + 2KCl
3) ZnCl2 + H2SO4 → ZnSO4 + 2HCl
4) Na2SO4 + 2KOH → K2SO4 + 2NaOH
16. Одним из продуктов гидролиза ортофосфата натрия по второй ступени является
1) NaH2PO4 3) Na2HPO4
2) H3PO4 4) NaHPO4
17. Щелочная среда образуется при растворении в воде каждой из двух солей
1) KNO3 и K3PO4 3) K2S и K3PO4
2) FeSO4 и KCl 4) K2SO4 и CH3COOK
18. В уравнении для расчета константы гидролиза цианида натрия не учитывается значение концентраций
1)  2)
2) 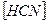 3)
3) 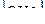 4)
4) 
19. Только окислительные свойства проявляет вещество
1) KClO4 2) KCl 3) KClO3 4) Cl2
20. Окислительно-восстановительную двойственность проявляют (два варианта ответа)
1) H2SO4 2) Na2SO3 3) H2S 4) S
ВАРИАНТ № 4
 2020-10-10
2020-10-10 168
168








