План лекции: Термохимия. Закон Гесса. Основные следствия закона Гесса и использование их для расчета тепловых эффектов физико-химических процессов. Зависимость теплового эффекта от теплоемкости и температуры. Уравнение Кирхгофа. Развернутое уравнение Кирхгофа.
Термохимия – это раздел термодинамики, который изучает тепловые эффекты процессов. В термохимии под тепловым эффектом 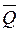 понимаюттеплоту, которая выделяется или поглощается в результате процесса, протекающего при постоянном р или V, причём температура исходных веществ и продуктов реакции одинакова, а полезная работа равна нулю (
понимаюттеплоту, которая выделяется или поглощается в результате процесса, протекающего при постоянном р или V, причём температура исходных веществ и продуктов реакции одинакова, а полезная работа равна нулю (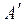 = 0).
= 0).
Закон Гесса – это основной закон термохимии. Формулировка закона: тепловой эффект процесса не зависит от числа и характера промежуточных стадий, а определяется только начальным и конечным состоянием системы.
Пример. Рассмотрим реакцию протекающую при р = const.
C(графит) + O2(газ) → CO2(газ); тепловой эффект реакции равен ∆H1.
Запишем реакцию через промежуточные стадии.
C(графит) + 0,5O2(газ) = CO(газ), ∆H2 ; (3.1)
CO(газ) + 0,5O2(газ) = CO2(газ), ∆H3; (3.2)
Просуммируем реакции (3.1) и (3.2):
C(графит) + O2(газ) → CO2(газ).
Получаем исходную реакцию; поэтому сумма тепловых эффектов реакций (3.1) и (3.2) равна тепловому эффекту исходной реакции: ∆H2 + ∆H3 = ∆H1.
Условие применения закона Гесса:закон применим только к тепловым эффектам процесса, т.е. к условиям, когда процесс протекает при р = const или V = const. Закон применим не только к химическим реакциям, но и к любым другим физико-химическим процессам.
Пример: ∆H возгонки = ∆H плав. + ∆H испар.
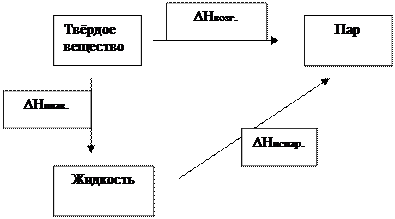
Термодинамическое обоснование закона Гесса заключается в следующем. Установлено, что QV = ∆U, а QP = ∆Н. Так как внутренняя энергия U и энтальпия H являются функциями состояния системы, т. е. не зависят от пути процесса, то QV и QP не будут зависеть от промежуточных стадий, а определяются только начальным и конечным состоянием системы.
 2014-02-04
2014-02-04 4006
4006








