Азот
Азот в сталь попадает чаще всего из атмосферы. Он, подобно углероду, образует в железе растворы внедрения. Растворимость азота в феррите при 590 o С составляет ~ 0,1 %, а при комнатной температуре – менее 0,001 o С.
В связи с изменяющейся растворимостью азота в феррите (рис. 70) и высокой энергией связи азота с дислокациями он вызывает деформационное старение стали. В результате деформационного старения увеличивается прочность и снижается вязкость и пластичность стали. Причем, эти изменения протекают медленно. Временнόе изменение свойств может привести к непредсказуемым результатам при эксплуатации деталей.
Для подавления деформационного старения в сталь при разливке вводят алюминий (около 5 кг на тонну стали), который образует с азотом стойкие нитриды и снижает концентрацию растворенного азота до безопасной величины. Деформационное старение можно подавить легированием стали другими элементами, имеющими высокое сродство к азоту или вакуумированием стали.
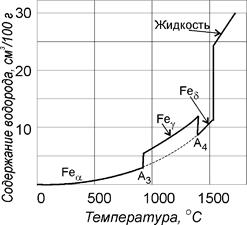 Рис. 71. Изобара растворимости водорода в железе Рис. 71. Изобара растворимости водорода в железе |
Водород с железом не образует химических соединений и всегда находится в виде твердого раствора внедрения. Изобарная кривая растворимости водорода в железе представлена на рис.71. видно, что растворимость водорода повышается с возрастанием температуры и зависит от фазового состояния железа. Растворимость увеличивается по схеме феррит 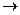 аустенит
аустенит 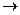 жидкость. Кривая растворимости в Fe d является продолжением кривой растворимости в
жидкость. Кривая растворимости в Fe d является продолжением кривой растворимости в 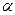 – области. Следует обратить внимание на то, что при фазовых переходах растворимость водорода меняется скачком.
– области. Следует обратить внимание на то, что при фазовых переходах растворимость водорода меняется скачком.
Водород поступает в сталь при ее выплавке в результате диссоциации водородосодержащих веществ. Так как сталь при выплавке находится при температурах выше 1500 o С, то его концентрация в жидкости превосходит равновесную концентрацию в феррите в 5...6 раз. Поэтому, при кристаллизации и охлаждении слитка водород должен удаляться в атмосферу.
Когда сталь находится в жидком состоянии, избыточный водород удаляется в виде пузырьков. После образования внешней корки твердой стали избыточный водород в расплаве, повышая парциальное давление, увеличивает собственную растворимость в твердой фазе и создаёт в ней пересыщение. Атомы [ Н ], находящиеся в твердом растворе вблизи поверхности поры, переходят в пору и создают в поверхностном слое поры обедненную водородом зону, разность концентраций которой является движущей силой диффузионного потока водорода в твердом растворе р [ Н ] (рис. 72, а). Атомарный водород в поре создает парциальное давление p [ H ], с нарастанием которого замедляется
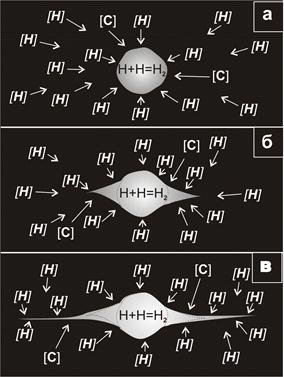 Рис. 72. Схема образования флокена в стали: [Н] – водород в твердом растворе; Н – водород в атомарном состоянии; Н2 – водород в молекулярном состоянии Рис. 72. Схема образования флокена в стали: [Н] – водород в твердом растворе; Н – водород в атомарном состоянии; Н2 – водород в молекулярном состоянии |
переход атомарного водорода в пору. Но в поре атомарный водород молизуется, превращаясь в молекулярный (Н 2). При этом парциальное давление атомарного водорода снижается, но растет парциальное давление молекулярного водорода Н2 (рис. 72, а). При этом непрерывно растущее парциальное давление молекулярного водорода (Н2) не препятствует переходу атомарного водорода из твердой фазы в полость поры.
Наиболее интенсивно парциальное давление Н2 растет при переходе через критическую точку Аr1, когда резко снижается растворимость водорода в стали. Пока сталь находится в аустенитном состоянии, релаксация напряжений, вызванных давлением молекулярного водорода, происходит посредством пластической деформации аустенита. В ферритной области, где пластичность стали резко снижается, возникает опасность образования трещин, вызванных высоким парциальным давлением молекулярного водорода в порах.
Если давление молекулярного водорода превысит предел прочности стали, то по периферии поры образуется трещина (рис. 72, б). давление молекулярного водорода снижается за счет увеличения объема поры и разрушение временно приостанавливается. Но давление вновь начинает возрастать вновь, причем более интенсивно, так как увеличилась поверхность поры за счет трещины, через которую поступают новые порции атомарного водорода. Процесс разрушения повторяется (рис. 72, в). Трещинообразование носит автокаталитический характер, так как каждый этап образования последующей трещины увеличивает поверхность, через которую атомарный водород переходит в полость поры, где происходит его молизация.
Если в стали кроме водорода присутствует достаточное содержание углерода, то последний на границе поры образует с атомарным водородом метан. Метан, независимо от концентрации молекулярного водорода создает дополнительное давление в поре, что интенсифицирует процесс трешинообразования. Доказательством этому является наличие обвзуглероженного слоя на поверхностях разрушения.
По этой причине с повышением в стали содержания углерода, она становится более склонной к внутреннему растрескиванию при кристаллизации слитков.
Эти трещины называют флокенами. Флокены не свариваются при прокатке и их размеры иногда достигают нескольких сантиметров в диаметре. Поэтому, слиток, содержащий флокены, не пригоден для дальнейшего использования.
Легирование стали Cr, Ni и рядом других элементов так же увеличивает склонность стали к образованию флокенов.
В настоящее время пользуются следующими методами для предупреждения их образования:
1. Разливка стали в вакууме.
2. Медленное охлаждение слитков после разливки стали с промежуточными выдержками при температурах фазовых превращений.
3. Прокатка слитка сразу же после кристаллизации (не охлаждая ниже 700 o С) и последующее медленное охлаждение проката в не отапливаемых коробах.
Флокены являются внутренними дефектами стальных изделий, которые нельзя обнаружить осмотром поверхности или исследованием образцов, полученных от полуфабрикатов. Причем, вероятность наличия флокенов возрастает с увеличением размеров слитка. Поэтому, крупногабаритные изделия высокой ответственности подвергаются 100 % контролю ультразвуковым методом.
 2014-02-04
2014-02-04 1296
1296
