ХИМИЧЕСКИЙ ЭЛЕМЕНТ
Ярослав в Киеве.
1017 г. и 1036 г. – блестящие победы Ярослава над печенегами.
1031 г. – в пограничном с печенегами Поросье селит военнопленных поляков.
1032 г. – строится система поросских сторожевых башен.
Оборонительные линии – для защиты от набегов степняков (печенегов, потом половцев) строились целые защитные системы, включавшие в себя военно-феодальные замки, сигнальные башни, земляные валы и рвы. При этом было бы неверно считать, что первые попытки отгородиться от степи возникают, только в XI в. Земляные валы стали строиться задолго до появления Киевской Руси, централизация государства только ускорили этот процесс. Валы, как правило, сопровождались рвом, но не имели дополнительных деревянных укреплений (частоколов).
[1] Сахаров А.Н. Дипломатия Древней Руси.
[2] Ч.с.х. Свенельд оставил Святослава во время возвращения в Киев из Византии, когда князь и был убит. Свенельд отправился в Киев другим путём вместе с варягами.
[3] Судя по договорам с греками на момент крещения была два официальных культа – Перуна и Велеса. То что Перуну собрали команду из супергероев, а Велеса туда даже не позвали, указывает на радикальный характер реформы.
|
|
|
Атомно-молекулярное учение (основные понятия и законы химии)
Атомно-молекулярное учение развил и впервые применил к химии М. В. Ломоносов. Основные положения этого учения изложены в его работе «Элементы математической химии» (1741 г.) и др. Сущность учения Ломоносова заключается в следующем: 1. Все вещества состоят из молекул (корпускул). 2. Молекулы состоят из атомов (элементов). 3. Частицы (молекулы, атомы) находятся в непрерывном движении. Тепловое состояние тел есть результат движения этих частиц. 4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ – из различных атомов.
Через 67 лет после Ломоносова, в 1808 г., атомистическое учение в химии применил английский ученый Джон Дальтон в книге «Новая система химической философии». В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, т. к. Дальтон впервые попытался установить атомные массы известных тогда элементов. Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX в., когда в 1860 г. на международном съезде химиков в г. Карсруэ (Швеция) были приняты определения понятий молекулы и атома.
По современным представлениям, атом – это электронейтральная частица, состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Неправильно говорить, что «атом – наименьшая частица химического элемента, сохраняющая все его химические свойства», т. к. химический элемент – это вид частиц (атомов, ионов, ядер) с определенным зарядом ядра; поэтому элемент не состоит из атомов! Кроме того, химические свойства – это энергетика и скорость химической реакции, а они зависят не только от состава реагирующей частицы, но и от ее энергетического состояния, геометрической формы и т. п., потому химическими свойствами обладают не атомы (и молекулы), а их совокупности – химические вещества.
|
|
|
Молекула – это электронейтральная наименьшая совокупность атомов, образующих определенную структуру посредством химических связей, определяющая состав вещества.
Закон постоянства состава вещества. Этот закон впервые сформулировал французский ученый химик Жозеф Луи Пруст в 1808 г.: Всякое чистое вещество независимо от способа его получения имеет постоянный качественный и количественный состав.
Пример: вещество вода может быть получено, например, следующими способами:
2Н2 + О2 → 2Н2О; NaOH + HCl → NaCl + H2O; С2Н5ОН + СН3СООН → СН3СООС2Н5 + Н2О.
Границы применения закона:
1. Постоянен лишь атомный состав вещества. Это объясняется существованием изотопов – ядер атомов, содержащих одинаковое число протонов, но разное число нейтронов, и поэтому имеющих разную массу.
Пример: 1). Если в молекуле воды содержится атом изотопа водорода протия 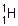 , то соотношение масс m (H): m (O) = 1: 8. 2). Если в молекуле воды содержится атом изотопа водорода дейтерия
, то соотношение масс m (H): m (O) = 1: 8. 2). Если в молекуле воды содержится атом изотопа водорода дейтерия  (D), то соотношение масс m (H): m (O) = 1: 4. 3). Если в молекуле воды содержится атом изотопа водорода трития
(D), то соотношение масс m (H): m (O) = 1: 4. 3). Если в молекуле воды содержится атом изотопа водорода трития 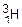 (Т), то соотношение масс m (H): m (O) = 3: 8. Однако, в каждом из этих случаев соотношение числа атомов водорода и кислорода одно и то же – 2: 1.
(Т), то соотношение масс m (H): m (O) = 3: 8. Однако, в каждом из этих случаев соотношение числа атомов водорода и кислорода одно и то же – 2: 1.
2. Закону постоянства состава подчиняются лишь вещества с молекулярной структурой (дальтониды). Вещества с атомной (например, карбид кремния SiC), металлической (например, тантал-диванадий V2Ta), ионной (например, сульфид железа (II) FeS) кристаллическими решетками не подчиняются этому закону (бертоллиды).
Закон постоянства состава вещества позволяет писать химические формулы.
Относительная атомная (Аr) и относительная молекулярная (Мr) массы – это числа, показывающие, во сколько раз масса атома или молекулы больше 1/12 массы атома изотопа углерода 12С.
Относительные атомная и молекулярная массы – безразмерные величины. Абсолютные массы атомов и молекул очень малы, поэтому в качестве единицы измерения используют не килограмм или грамм, а атомную единицу массы (а. е. м.), которая равна 1/12 m(12С) = 1,66057×10–24 кг. Т. о. Аr(Аl) = 27 – это относительная атомная масса алюминия, а mo(Al) = 27 а. е. м. – абсолютная масса атома алюминия.
Моль – это количество вещества, содержащее столько же структурных единиц (атомов, ионов, ядер, электронов, радикалов и т. п.), сколько содержится атомов в 12 г углерода 12C.
В одном моле любого вещества содержится число Авогадро структурных единиц, а именно: NA = 6,02×1023 структурных единиц.
Молярная (мольная) массаМ – это масса 1 моль вещества, выраженная в единицах массы. Например, M(Al) = 27 г/моль; M(H2SO4) = 98 г/моль.
Молярный (мольный) объем Vm – объем 1 моль вещества, выраженный в единицах объема. Например, Vm(CO2) = 22,4 л/моль (н. у.: Т = 273,15 К, p = 101325 Па); Vm(H2O) = 18 мл/моль.
Закон Авогадро: В равных объемах различных газов при одинаковых условиях (Т, р) содержится равное число молекул.
Следствия из закона Авогадро:
1. При одинаковых условиях 1 моль любого газа занимает одинаковый объем. При н. у. Vm (газа) = 22,4 л/моль.
2. Молярная масса вещества в газообразном состоянии равна его удвоенной плотности по водороду.
Относительная плотность газа – это число, показывающее, во сколько раз один газ тяжелее другого.
Химический элемент – вид атомов, ионов, ядер с определенным зарядом ядра.
Основными характеристиками химического элемента являются: заряд ядра, относительная атомная масса, распространенность.
|
|
|
Простое вещество – это химический элемент в свободном виде.
Сложное вещество (химическое соединение) – это химически индивидуальное вещество, состоящее из атомов различных элементов, химически связанных между собой.
Современные представления о строении атома
Атом представляет собой сложную систему находящихся в движении и взаимодействии элементарных частиц. Экспериментально установлено, что каждый атом состоит из 2-х областей, несущих противоположные заряды. Заряд области, где сосредоточена почти вся масса атома, условно принято считать положительным. Эта область названа ядром атома. На некотором расстоянии от ядра располагаются области с отрицательным зарядом – электронные орбитали, т. е. области определенной вероятности нахождения электрона.
Носителями положительного заряда ядер являются протоны. За исключением ядра атома водорода, согласно протонно-нейтронной теории (Дмитрий Дмитриевич Иваненко, Россия, Вернер Гейзенберг, Германия, 1932 г.), ядра содержат также и нейтроны. Протон и нейтрон – два состояния ядерной частицы нуклона:
| Элементарная частица | Заряд, относительные единицы (в скобках указаны абсолютные заряды в Кл). | Масса, относительные единицы (в скобках указаны абсолютные массы в кг) |
| Протон р | +1 (1,602×10–19) | 1,007276 (1,6726×10–27) |
| Нейтрон n | 0 | 1,008665 (1,67495×10–27) |
| Электрон е | –1 (1,602×10–19) | 5,485799×10–4 (9,1094×10–31) |
Общее число нуклонов в ядре равно относительной атомной массе.
Число протонов в ядре равно заряду ядра Z, выраженному в единицах заряда электрона (относительных единицах). Число нейтронов N равно разнице (Ar–Z). Число электронов в атоме равно числу протонов (заряду ядра).
Задания для самостоятельной работы
1.1. Из молекул, а не из атомов и ионов, состоит:
1) сухой лед; 2) алмаз; 3) латунь; 4) поташ.
1.2. Трехэлементное вещество – это:
1) бертолетова соль; 2) оксид азота (III); 3) питьевая сода; 4) ацетат натрия.
1.3. Веществами молекулярного строения являются все вещества ряда:
1) сера, поваренная соль, сахар; 2) поваренная соль, сахар, глицин;
|
|
|
3) сахар, глицин, медный купорос; 4) сера, сахар, глицерин.
1.4. Атом изотопа калия 40К содержит ___ протонов. Ответ запишите цифрами.
1.5. Химический элемент, один из изотопов которого имеет массовое число 44 и содержит в ядре 24 нейтрона, – это:
1) хром; 2) кальций; 3) рутений; 4) скандий.
1.6. Массовое число изотопа равно:
1) массе протонов и электронов в атоме; 3) массе всех составляющих его частиц;
2) числу протонов и нейтронов в его ядре; 4) числу всех частиц в его составе.
 2014-02-02
2014-02-02 3489
3489







