Термодинамика возникла как наука о превращениях теплоты в работу. Основу термодинамики образуют её два начала.
Первое начало термодинамики. Количество теплоты Q, сообщаемое замкнутой системе, идет на приращение внутренней энергии Δ U системы и совершение системой работы A, производимой системой против внешних сил:
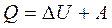 (1)
(1)
где Q>0 – если тепло подводится к системе;
Q<0 – если тепло отводится от системы;
A>0 – если система производит работу против внешних сил;
A<0 – если над системой внешними силами совершается работа.
Закрытая термодинамическая система – это система, которая не может обмениваться только веществом с внешней средой (например, космический корабль).
Открытая термодинамическая система – это система, которая может обмениваться веществом с внешней средой. Замкнутая (изолированная) термосистема – это система, которая не может обмениваться ни веществом, ни энергией с внешней средой.
Согласно первому началу термодинамики в определенных термодинамических системах могут протекать такие процессы, при которых полная энергия системы остается неизменной.
Переход теплоты от горячего тела к холодному и механической энергии во внутреннюю – это примеры наиболее типичных необратимых процессов. Число подобных примеров можно увеличивать практически неограниченно. Все они говорят о том, что процессы в природе имеют определенную направленность, никак не отраженную в первом начале термодинамики. Все макроскопические процессы в природе протекают только в одном определенном направлении, в обратном направлении они самопроизвольно протекать не могут. Все процессы в природе не обратимы, и самые трагические из них – старение и смерть организмов.
Для правильного понимания существа необратимости процессов необходимо сделать следующее уточнение: необратимыми называются такие процессы, которые могут самопроизвольно протекать только в одном направлении; в обратном направлении они могут протекать только как одно из звеньев более сложного процесса.
Второе начало термодинамики указывает направление возможных энергетических превращений и тем самым выражает необратимость процессов в природе.
Немецкий ученый Р. Клаузиус (1822 -1888) сформулировал этот закон так: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или в окружающих телах.
Здесь констатируется опытный факт определенной направленности теплопередачи: теплота сама собой переходит всегда от горячих тел к холодным. Правда, в холодильных установках осуществляется теплопередача от холодного тела к более теплому, но эта передача связана с другими изменениями в окружающих телах: охлаждение достигается за счет работы.
Для того, чтобы определить какие процессы могут протекать в изолированной термодинамической системе, нужно знать вероятность различных состояний этой системы. Величина, которая служит для характеристики вероятности состояний, получила название энтропии. Энтропия – мера хаоса, беспорядка системы. Приращение энтропии определяется формулой:
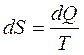 (2)
(2)
где dQ – количество теплоты, полученное (или отданное) системой. T – термодинамическая температура системы. Из определения S вытекают следующие свойства энтропии:
1) В ходе необратимого процесса энтропия изолированной системы возрастает («стрела времени»)
2) Энтропия изолированной системы, находящейся в равновесном состоянии, максимальна. При повышении температуры хаос системы возрастает, а, следовательно, возрастает энтропия.
Это означает, что такие системы эволюционизируют в сторону увеличения в них хаоса, беспорядка, пока не достигнут точки термодинамического равновесия, в которой всякое производство работы оказывается невозможным.
Гипотеза Клаузиуса, основанная на представлении Вселенной закрытой системой, является абстракцией, не отражающей реальный характер природных систем, которые способны обмениваться энергией, веществом и информацией с окружающей средой, т.е. являются открытыми системами. В открытых системах также производится энтропия, т.к. имеют место необратимые процессы, но в отличие от закрытых систем она не накапливается, а выводится в окружающую среду. Открытые системы живут за счет заимствования порядка из внешней среды.
 2014-02-02
2014-02-02 2132
2132
