Вода.
В строительстве воду применяют для замешивания цемента, извести, глины. Природные воды воздействуют на строительные сооружения, вызывая их коррозию (разрушение) как в наземных, так и в подземных (подводных) частях. При работе на мёрзлых грунтах имеют дело со льдом, как со своеобразным компонентом горной породы, лежащем в основе сооружений.
Свойства воды:
Физические:
а) соединение без вкуса, запаха и цвета
б) во многих отношениях отлична от других жидкостей
в) ρ воды при охлаждении падает => замерзание воды в трубах может привести к разрыву стальных труб; лёд в трещинах строительных сооружений приводит к разрушению; особо этому процессу благоприятствует чередование положительных и отрицательных температур (днём «+», ночью «—»; чередование оттепели и заморозка)
г) аномально высокая теплоёмкость: CH2O=4,18 Дж/г*к (это благоприятно сказывается на температуре Земли: накопленное днём (летом) тепло медленно отдаётся окружающей среде ночью (зимой).
Д) аномально высокие температуры плавления и кипения
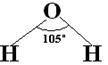 μ=1,86 Д => высокая химическая активность
μ=1,86 Д => высокая химическая активность
Н хороший лиганд Н2О
хороший лиганд Н2О
 О
О хороший донор
хороший донор
Аномалии физических свойств воды объясняются ассоциацией молекул воды за счёт водородной связи.
ВС- связь водорода с сильно электроотрицательными элементами. (с O, F, Cl, N)
H+ т.к. нет электронной оболочки, проникает в чужую не испытывая сил отталкивания => даёт доп. Связь
ВС на порядок сильнее ковалентной связи, но слабее электромагнитной.
Диаграмма состояния воды
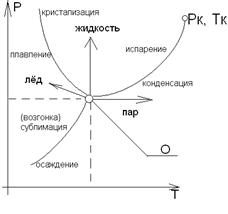 Тк и Рк – критические температура и давление выше которых ни при каких Т и Р нельзя перевести пар в жидкость и наоборот.
Тк и Рк – критические температура и давление выше которых ни при каких Т и Р нельзя перевести пар в жидкость и наоборот.
 Тройная точка О-в ней все 3 фазы находятся в равновесии.
Тройная точка О-в ней все 3 фазы находятся в равновесии.
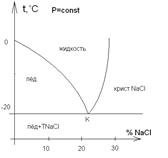
Диаграмма водно-солевого раствора
К - криогидратная точка
Н2О может быть окислителем и восстановителем: Н2О+F2→2HF+1/2 O2
(-) Анод: 2 Н2О-4е= O2+4Н+
Н2О= Н++OH-
Концентрация ионов Н+ в воде 1*10-7 моль/л
Оксиды многих металлов взаимодействуют с H2O: SO3+H2O= Н2SO4
Соли в результате взаимодействия с водой могут подвергнуться гидролизу или гидратации
Na2CO3+10 H2O= Na2CO3ּ10 H2O
Вода катализирует очень многие реакции: Me+Cl2; Na+O2; HF+стекло.
Жёсткость воды:
Природные воды очень сильно отличаются по своему составу (содержанию ионов растворимых веществ); это сказывается на коррозии металлов, бетона, природных каменных материалов.
Жёсткость обуславливают наличием ионов Ca2+ и Mg2+
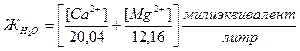 мягкая <3 мэкв/л, жёсткая >6(8) мэкв/л
мягкая <3 мэкв/л, жёсткая >6(8) мэкв/л
Жёсткая вода даёт накипи на паровых котлах, вызывая перерасход топлива и создавая угрозу взрыва
Жёсткость: временная (Ca(HCO3)2, Mg(HCO3)2); постоянная (Ca2+,Mg2+, Cl-, SO42-)
Ca(HCO3)2→t CaCO3↓+CO3+H2O
Н2Оможно умягчить ионно-обменными смолами (высоко молекулярные в-ва, спос. обмениваться с окр. средой) ВМС (аниониты, катиониты)
| Опреснение: H+форма→ H+ |
| OH-форма→ OH- H2O |
NaR+MgSO4=Na2SO4+MgR2
 2014-02-04
2014-02-04 636
636








