- Реакции протекают необратимо, если продукты уводятся из газовой среды в виде осадка, газа или мало диссоциируемого вещества.
AgNO3+KCl=AgCl+KNO3
Zn+H2SO4=Zn+H2↑
KON+HNO3=KNO3+H2O
- Обратимые реакции идут до определённого предела и как бы восстанавливаются, идёт обратная реакция.
CO2→←CO+H2O
N2+3H2→←2NH3
Состояние системы, когда концентрация веществ не изменяется во времени называется химическим равновесием. Это равновесие динамичное, подвижное, т.к. одновременно идут как прямая, так и обратная реакции, но одна сводит на нет результаты другой
Критерием химического равновесия является равенство скоростей прямой и обратной реакции.Vпр=Vобр.
| V1=k1[A][B] V2=k2[C][D] V1=V2 | k1[A][B]=k2[A][B] 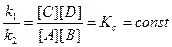 |
 Применим з. д. м. для прямой и обратной реакции для уравнения А+В→←С+D
Применим з. д. м. для прямой и обратной реакции для уравнения А+В→←С+D
Kc-константа химического равновесия, выраженная через концентрацию, зависит от природы и температуры
В случае гетерогенных реакций в константу равновесия не входит концентрация твёрдой фазы.
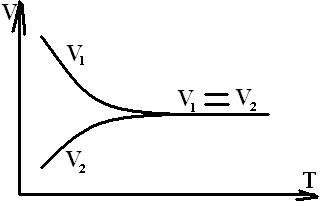
Состояние равновесия зависит от: Температуры, концентрации, давления.
Смещение равновесия подчиняется принципу Ле Шателье: «Если изменить одно из условий, при котором система находится в равновесии (С, Т, Р), то равновесие смещается в сторону реакции, противодействующей произведенному воздействию».
4 моля 2 моля
N2+3H2=2NH3; ΔH<0
 ↑T
↑T
 ↑P ↑C исходного вещества →
↑P ↑C исходного вещества →
↑С продукта ß
 ↑C(H2)
↑C(H2)
 2014-02-04
2014-02-04 958
958








