Характерным химическим свойством Ме является их восстановительная способность, т.к. атомы Ме элементов отличаются склонностью образовывать положительно заряженные ионы
а) с галогенами легко взаимодействуют, с образованием галогенидов. Это в значительной мере обуславливается небольшой Е диссоциации молекул галогенов
б) с кислородом Ме взаимодействуют менее энергично, образуются оксиды
в)с азотом многие Ме вообще не взаимодействуют. Лишь немногие металлы способны гореть в атмосфере азота с образованием нитридов
в) с серой многие Ме взаимодействуют, легче при нагревании, особенно легко идет взаимодействие с расплавленной серой
г) с водородом активные Ме взаимодействуют с образованием гидридов
д) действие воды на различные Ме весьма разнохарактерно, и зависит от активности ме. Жидкая вода для активных Ме является источником водородных ионов и разлагается ими
Me + nHOH=Me(OH)n + n/2H2
Некоторые малоактивные Ме на которые чистая вода совсем не действует. Водой с растворенным в ней кислородом окисляется по схеме:
Me + n/2H2O +n/4O2 = Me(OH)n
е) щелочами Ме окисляться не могут, т.к щелочные Ме являются одними из наиболее сильных восстановителей. Поэтому их ионы одни из наиболее слабых окислителей, в водных растворах практически свойств окислителя не проявляют. Однако в присутствии щелочей окисляющее действие воды может проявляться в большей мере, чем в их отсутствие. В результате пассивные в чистой воде Ме могут энергично взаимодействовать с растворами щелочей.
Амфотерный Ме + щелочь + вода= комплекс и водород
Взаимодействие с солями менее активных Ме (более акт Ме вытесняет из соли менее акт)Не подходят щелочные и щелочноземельные Ме, т.к они взаимодействуют с водой
ж)действие некоторых кислот на Ме и особенности.. особенности действия азотной кислоты на Ме заключается в том, что она окисляет Ме без выделения Н2 даже из разбавленного раствора. Концентрированная азотная кислота действует на все Ме кроме благородных.
HNO3(разб) + неакт Ме = NO
HNO3(разб)+Ме ср актив = N2O, N2 + cоль и вода
HNO3(разб)+актив Ме= NH4
HNO3 (конц) +Ме = NO2 +cоль и вода
При взаимодействии Ме с кислотами, анионы которых не проявляют окислительных свойств (HCl, H2SO4, H2S, CH3COOH,) в качестве окислителя выступает Н+. Реакция возможна, если Ме в ряду напряжения до водорода.
При взаимодействии Ме с кислотами, анионы которых проявляют окислительные свойства (H2SO4к, HNO3) H2 не выделяется
H2SO4конц + акт Ме = H2S
H2SO4конц+ Ме ср актив = S + cоль и вода
H2SO4конц+ неактив Ме = SO2
Двойной электрический слой на границе «металл – раствор»
При погружении Ме платины (электрода) в раствор соли данного Ме может происходить один из 2 процессов:
1) Если Ме актив восст, то под действием диполей воды некоторая часть атомов Ме оставляет свои электроны на электроде и в виде гидратированных ионов переходит в раствор:
Me +mH2O = Me(n+)*mH2O +ne-
Или без учета гидратации ионов:
Me=Me(n+) +ne-
В результате этого процесса окисления Ме пластинка заряжается отрицательно, а катионы Ме притягиваются к ней, и поэтому прилегающий к пластинке слой раствора заряжается положительно. Таким образом на границе «Ме-раствор» возникает двойной электрический слой(ДЭС)
2) Если сам Ме является слабым восст, то его ионы, содержащиеся в растворе соли, являются сильными окислителями. Некоторая часть этих ионов подходит к поверхности Ме пластины и восст за счет имеющихся в ней свободных электронов
Me(n+) + ne- = Me
В результате осаждения катионов пластина Ме заряжается положительно и притягивает к себе отриц заряженные анионы. Поэтому прилегающий к пластине слой раствора заряжается отрицательно. Таким образом и в этом случае возникает ДЭС.
Разность потенциалов, возникающая в ДЭС на границе «Ме-раствор», называется электродным потенциалом.
Зависимость электродного потенциала от концентрации раствора выражает уравнение Нернста
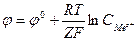
R – универсальная газовая постоянная, Т – абсолютная температура, Z- заряд иона Ме, F – постоянная Фарадея=96500 кл/моль, С – концентрация ионов ме в растворе
Потенциал зависит от природы, температуры и концентрации. Пусть 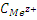 в растворе = 1 моль/литр, тогда
в растворе = 1 моль/литр, тогда 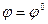 , φ0 – стандартный электродный потенциал
, φ0 – стандартный электродный потенциал
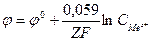
В настоящее время измерить абсолютное значение эл. Потенциала нельзя, однако можно измерить разность потенциалов, возникающую при составлении элемента из 2 электродов. Поэтому условились считать потенциал водородного электрода в стандартных условиях равным 0. Водородный электрод представляет собой платиновую пластинку, насыщенную водородом (при атмосферном давлении) и погруженную в раствор, содержащий ионы водорода. Тогда ЭДС элемента, составленного из нормального водородного электрода и данного электрода численно равна электродному потенциалу.
Ов потенциалы - в ОВР передача электронов от в-ля к ок-лю обычно происходит при непосредственном контакте реагирующих в-в. При этом энергия хим реакции превращается в тепловую. Однако процессы ок-ия и восст-ия можно пространственно разделить. так чтобы электроны передавались от в-ля к ок-лю через Ме проводник, тогда Е хим р-ии превратится в электрическую. Для этого необходимо в растворы, содержащие соответственно ок-ль и в-ль опустить инертные электроды(которые не дают своих ионов)(платина, золото, графит)
Замыкая электроды и электролит, получают ток. На платиновых электродах возникает потенциал о/в, величина которого будет определяться соотношением концентрации окисленной и восстановленной формой в-ва по уравнению 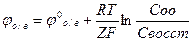
Если Сок=Свосст, то 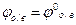 (стандартный ок-восст потенциал) Реакция возможна, только если
(стандартный ок-восст потенциал) Реакция возможна, только если 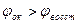 , элемент работает при условии, что его эдс положительна. Эдс =
, элемент работает при условии, что его эдс положительна. Эдс =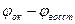
 2014-02-04
2014-02-04 822
822








