Гальванический элемент и его ЭДС
Электрод с меньшим алгебраическим значением потенциала – АНОД, на нем всегда идет окисление. Электрод с большим алг значением потенциала – КАТОД, на нем восстановление. Если ЭДС положительна, то элемент работает. ГЭ Даниэля-Якоби – обратимый элемент, т.к при смене направления тока на электродах будут идти те же процессы, но противоположных направлений.
Коррозия Ме – разрушение Ме под действием окр среды. Хим суть коррозии в том, что Ме, теряя электроны окисляется. Коррозию делят на химическую(в газах и неэлектролитах) и электрохимическую (возникающую в результате контакта 2 разных Ме в среде электролита) любой технический Ме содержит примеси других ме, поэтому в среде электролита начинает работать большое количество микроГЭ. Коррозии будет подвергаться более активный ме, выполняющий роль анода. Со временем ЭДС коррозионного элемента падает, процесс коррозии затухает – явление поляризации. Частицы среды, которая разряжается на поверхности менее активного Ме, наз-ся ДЕПОЛЯРИЗАТОРЫ. На практике чаще всего наблюдают коррозию с кислородной и водородной деполяризацией, т. к это самые распространенные в природе окислители(О2 содержится в воздухе, а Н+ в воде и ее растворах). Если О2 присутствует, то коррозия всегда идет с кислородной деполяризацией, т. к независимо от характера среды О2 более сильный ок-ль чем Н+.
В зависимости от характера среды и природы деполяризатора на катоде (менее активном Ме) идут следующие процессы:Коррозия с водород деполяризацией:
Кисл среда – 2Н+ + 2е-=Н2
Нейтр и щел среда – 2Н2О+2е-=Н2+2ОН-
Коррозия с кислород деполяризацией
Кисл среда – О2+4е-+4Н+=2Н2О
Нейтр и щел – О2+2Н2О=4ОН-
1) Защитные покрытия: неМе – лаки, краски, эмаль, резина, пластмасса; Ме - анодные Fe/Zn в кислой среде или Fe/Sn в кисл среде
2) изменение состава среды или состава ме
- в среду, где работают Ме конструкции, вводят ингибиторы – замедлители коррозии – Na2CrO4, альдегиды
- анодирование, воронение, азотирование, фосфотирование – создание на поверхности ме защитной пленки из соединений этого же ме
3) электрохимические методы защиты
- протекторная защита (протектор – специальный анод из более активного ме, который прикрепляют к защищаемому изделию. Протектор, разрушаясь, защищает Ме конструкцию от коррозии)
- электрозащита (защищаемую конструкцию присоединяют к «-»внешнего источника постоянного тока, а к «+» присоединяют кусок стального Ме(рельс, балка) поддержка оптимального напряжения - защита от коррозии)
Электролиз - ОВР, протекающая при пропускании постоянного тока через электролит. Анионы к аноду, катионы – к катоду. Анод (+) – окисление, катод (-) восстановление. Потенциал разряда ионов зависит от материала электрода, плотности тока. Состояния поверхности. Разность между фактическими потенциалом разряда иона и его теоретическим(рассчитанным по уравнению Нернста значением называется перенапряжением. η=φфакт-φтеор, η- дополнительное напряжение, которое необходимо дать для преодоления побочных процессов. Особо высокое перенапряжение сопровождает разряд ионов газа. Для ме им можно пренебречь, для газов очень большое.
Катодное η - смещение потенциалов катода в сторону отрицательных значений, анодное 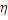 - смещение потенциала анода в сторону положительных значений. Из-за перенапряжения идет увеличение по модулю
- смещение потенциала анода в сторону положительных значений. Из-за перенапряжения идет увеличение по модулю 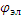
При электролизе водных растворов необходимо учитывать возможность разряда ионов среды. 1) электролиз с нерастворимым анодом
А) электролиз водного раствора HCl c Pt электродами
HCl=H+ +Cl-
H2O=H+ +OH-
Катод(-): 2H+ +2e- = H2 Анод(+) 2Cl- - 2e- = Cl2
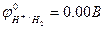
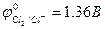
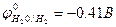
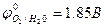 С учётом перенапряжения О2.
С учётом перенапряжения О2.
На катоде всегда в первую очередь разряжаются те катионы, потенциал которых больше по своему алг значению (с учетом знака), т.е более сильные окислители восстанавливаются первыми
На аноде окисление, в первую очередь окисляются те анионы, потенциал разряда которых меньше по своему алг значению, т.е более сильные восстановители окисляются в первую очередь.
Б) электролиз водного раствора ZnSO4 с графитовыми электродами
ZnSO4= Zn2+ + SO42-
H2O=H+ +OH-
Катод (-) Zn+2 +2e- = Zn Анод(+) 2H2O – 4e- = O2 +4H+
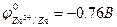
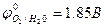 С учётом перенапряжения О2.
С учётом перенапряжения О2.
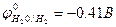 С учётом перенапряжения водорода
С учётом перенапряжения водорода 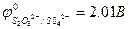
2) Электролиз с растворимым анодом. Применяют при рафинировании Ме от примесей а также при нанесении Ме покрытий
(-) Zn-2e=Zn+2
Fe-2e=Fe2+
Cu-2e=Cu+2
(+) Cu+2 +2e=Cu
Напряжение на ванне поддерживается таким образом, чтобы Ме, расположенные в ряду стандартных потенциалов после меди. Не смогли раствориться. Поэтому они выкрашиваются в виде шлама на дно ванны. На катоде получили чистейшую медь. Процесс сводится к переносу Ме с анода на катод
Электролиз распавов. Им получают активные Ме. Т. к здесь нет конкурирующих ионов воды. Основным законом электролиза является закон Фарадея - для того, чтобы выделить в процессе электролиза 1 грамм- эквивалент любого в-ва необходимо затратить одно и то же кол-во электричества, а именно 96500 Кл
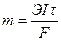 m- масса I – сила тока τ- время в секундах F- постоянная Фарадея Э- эквивалентная масса продукта электролиза, Э=атомная масса/валентность
m- масса I – сила тока τ- время в секундах F- постоянная Фарадея Э- эквивалентная масса продукта электролиза, Э=атомная масса/валентность
 2014-02-04
2014-02-04 1054
1054
