Образование ковалентной связи в молекуле водорода Н2
Электронная формула молекулы,

 H· + ´H ®
H· + ´H ®  (
(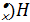
 |
Электроны Общая электронная пара
Общая электронная пара обозначается черточкой: Н—Н. Общая электронная пара принадлежит обоим атомам, поэтому каждый атом водорода в молекуле Н2 имеет завершенную электронную структуру 1s2.
Квантово-механичеекая теория электронного строения атомов объясняет образование общей электронной пары как перекрывание электронных облаков. В перекрывании могут участвовать электронные облака неспаренных электронов, которые имеют антипараллельные спины.
Схема перекрывания электронных облаков в молекуле водорода Н2
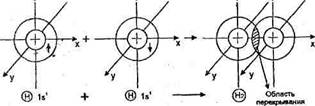
Область перекрывания электронных облаков — это область высокой плотности отрицательного заряда, который притягивает положительно заряженные ядра атомов.
Связь в молекуле Н2 является s-связью (сигма).
s-Связи — это ковалентные связи, при образовании которых область перекрывания электронных облаков находится на линии, соединяющей ядра атомов.
Связь в молекуле Н2 является примером одинарной (простой) связи.
· Одинарные (простые) связи — это ковалентные связи, которые образованы одной общей электронной парой.
Одинарные (простые) связи всегда являются s-связями. Ковалентные связи бывают одинарными, двойными, и тройными. Если связь между двумя атомами образована двумя общими электронными парами, то такая связь называется двойной связью. Если связь между двумя атомами образована тремя общими электронными парами, то такая связь называется тройной связью. Двойные и тройные связи называются кратными связями. Двойная связь состоит из одной s-связи и одной p-связи. Тройная связь состоит из одной s-связи и двух p-связей.
p-Связи — это ковалентные связи, при образовании которых область перекрывания электронных облаков находится по обе стороны от линии, соединяющей ядра атомов.
В образовании p-связей могут участвовать р- и d-облака (т.е. р- и d-электроны), но не могут участвовать s-облака (s-электроны). Например:
Ковалентные связи бывают полярными и неполярными.
· Неполярная связь — это ковалентная связь между атомами с одинаковой электроотрицательностью (ЭО); при образовании неполярной связи область перекрывания электронных облаков находится на одинаковом расстоянии от ядер обоих атомов.
Неполярными являются связи в молекулах простых веществ: Н2, О2, Cl2, N2 и др.
· Полярная связь — это ковалентная связь между атомами с различной ЭО; при образовании полярной связи область перекрывания электронных облаков смещается в сторону атома с большей ЭО (в сторону более электроотрицательного атома).
Например, в молекуле хлороводорода НСl общая электронная пара (т. е. область перекрывания электронных облаков) смещается в сторону атома хлора, потому что он является более электроотрицательным:
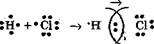
 2014-02-02
2014-02-02 1987
1987
