Можно подразделять системы по числу компонентов, степеней свободы и по числу фаз.
1). По числу компонентов ситемы классифицируют как
– однокомпонентные (или одинарные);
– двухкомпонентные (или двойные);
– трёхкомпонентные (или тройные) и т. д.
2). По числу фаз системы классифицируют как
– однофазные;
– двухфазные;
– трёхфазные и т. д.
3). По числу степеней свободы (вариантности) системы классифицируют как
– безвариантные или нонвариантные ( f = 0);
– одновариантные или моновариантные ( f = 1);
– двухвариантные или бивариантные ( f = 2) и т. д.
Число компонентов определяют как наименьшее число составляющих частей системы, достаточное для образования всех её фаз. Число компонентов не равно числу составляющих частей лишь в тех случаях, когда между ними происходят химические взаимодействия (реакции) и в системе устанавливается химическое равновесие. В этом случае число компонентов равно числу составляющих частей системы минус число уравнений, связывающих концентрации составляющих частей.
В однокомпонентных системах при р, Т = const условием равновесия является равенство энергий Гиббса сосуществующих фаз в расчёте на одно и тоже количество вещества (моль, кг). Из соотношения
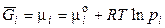
следует, что при равновесии парциальное давление насыщенного пара каждого компонента должно быть одинаковым для всех фаз.
Максимальное число степеней свободы в однокомпонентных системах равно:
 . (9)
. (9)
Состояние таких систем можно описать на плоскости с двумя осями переменных (р и Т).
Максимальное число сосуществующих фаз (f = 0)в однокомпонентной системе равно
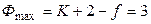 . (10)
. (10)
Система трёхфазная и безвариантная. Это означает, что три фазы находятся в равновесии при строго определенных (и зависимых друг от друга) значениях переменных (температуре и давлении).
Диаграммой состояния называется график, выражающий зависимость состояния системы от внешних условий или от состава системы.
Независимые термодинамические параметры – параметры, которые могут быть изменены произвольным образом без изменения числа сосуществующих фаз.
Так, для однокомпонентной системы (К = 1):
1). Ф = 1 Þ f = 2, т.е. в гомогенных системах р и Т можно менять произвольно.
2). Ф = 2 Þ f = 1, следовательно, р может изменяться независимо, а температура является функцией давления (Т = f (р)), т. е. становится зависимым параметром.
3). Ф = 3 Þ f = 0, т.е. температура и давление строго определены. Малейшее изменение любой из этих величин приведёт к исчезновению одной или двух фаз. Например, если рассматривать диаграмму состояния воды (рис. 1), повышение температуры при постоянном давлении или понижение давления при постоянной температуре переводит систему в состояние пара. Повышение при постоянной температуре переводит систему в состояние жидкой воды, а понижение температуры при постояном давлении – в состояние льда.
 2014-02-05
2014-02-05 5418
5418








