При образовании сплавов встречаются следующие группы химических соединений и промежуточных фаз:
1. Химическое соединение с нормальной валентностью,
2. Электронные соединения,
3. Фазы внедрения.
Характерные особенности химических соединений:
1. Кристаллическая решетка отличается от решеток компонент, образующих соединение. Атомы в решетке химического соединения располагаются упорядоченно, т. е. атомы каждого компонента расположены закономерно и по определенным узлам решетки. Большинство химических соединений имеют сложную кристаллическую структуру.
2. В соединении всегда сохраняется простое кратное соотношение компонентов. Это позволяет выразить их состав простой формулой АnBт, где А и В – соответствующие элементы; n и т – простые числа.
3. Свойства соединения резко отличаются от свойств образующих его компонентов.
4. Температура плавления (диссоциации) постоянная.
5. Образование химического соединения сопровождается значительным тепловым эффектом.
(В отличие от твердых растворов химические соединения обычно образуются между компонентами, имеющими большое различие в электронном строении атомов и кристаллических решеток. Как правило, химические соединения между металлами (интерметаллические соединения) обладают более высокой твердостью, чем каждый металл в отдельности. Химические соединения с нормальной валентностью характеризуются почти полным отсутствием растворимости в них в твердом состоянии компонентов, из которых они образовались.) Mg2Sn, Mg2Si и др.
Фазы внедрения (для курса «Материалы со спец свойствами»)
Фазы внедрения представляют собой большую группу промежуточных фаз в металлических системах, образующихся путем соединения металлов переходных групп с водородом, углеродом или азотом (карбиды, нитриды, гидриды, бориды).
Характер структуры этих соединений определяется соотношением атомных радиусов металла (rм) и металлоида (rx) Если это отношение: rx/rм <0,59, то атомы металла образуют обычную простую кристаллическую решетку в свободные промежутки которой внедряются атомы металлоида. Структуры, удовлетворяющие этому соотношению, называются фазами внедрения. При отношении >0,59 образуются соединения со сложными кристаллическими решетками, не отвечающими структурам фаз внедрения. К ним принадлежат все бориды и карбиды хрома, марганца и железа.
Карбиды, нашедшие широкое применение для изготовления так называемых «твердых сплавов», имеют структуру фаз внедрения. Металлы в фазах внедрения образуют одну из следующих кристаллических решеток:
1) кубическую гранецентрированную решетку;
2) кубическую объемноцентрированную решетку;
3) гексагональную компактную решетку с отношением осей в идеальном случае с/а= 1,633;
4) простую гексагональную решетку с отношением осей в идеальном случае с/а= 1
Особенностью фаз внедрения, в отличие от граничных твердых растворов (твердых растворов внедрения, имеющих те же решетки, что и чистые металлы), является то, что почти все они обладают кристаллическими решетками, отличными от решеток металлов, на базе которых они образовались. Это объясняется «внутренним давлением», возникающим при образовании фаз внедрения. Экспериментальные исследования подтверждают возможность полиморфного превращения под влиянием высоких давлений. (Так, гранецентрированная решетка рубидия при давлении в 22000 атм переходит в объемноцентрированную. Расчеты внутренних давлений, возникающих при образовании фаз внедрения, дают величины порядка 200000 – 300000 атм. Под действием давлении и происходит перестройка кристаллических решеток. Кроме того, имеются данные, которые дают основание полагать, что под действием высоких давлений в фазах внедрения происходит переход водорода и других металлоидов в металлическое состояние.)
Фазы внедрения могут быть представлены в общем виде формулами: Me4X, Ме2Х, МеХ, МеХ2, где Ме – металл, X– металлоид.
При размещении атомов металлоида в местах «Х» каждый металлоидный атом будет иметь шесть равноудаленных атомов металла, т. е. его координационное число будет равно 6. В таком случае атомы металлоида размещаются внутри октаэдров. При заполнении всех октаэдров решетка будет иметь состав, соответствующий 50% (атомных) металлоида. В результате заполнения образуется решетка типа NaCl. Такой способ расположения атомов в кристаллической решетке в фазах внедрения встречается наиболее часто.
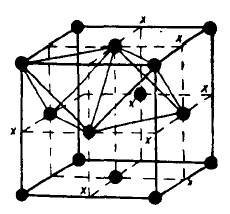 |
| Гранецентрированная решетка с предположительным расположением металлоидных атомов в центре октаэдров |
При отношении rX/rM =0,41 – 0,59 атомы металлоида в фазе внедрения располагаются внутри октаэдров. В случае если это отношение меньше 0,41, структура решетки фазы внедрения становится неустойчивой, так как атомы металлоида не заполняют объема октаэдрических пустот.
Но положение может измениться, если вместо одного атома металлоида мы будем иметь два атома металлоида, расположенные в тех же октаэдрических пустотах. В результате такого внедрения получается структура характерная для гидрида циркония (rX/rM = 0,29). При этом кубическая гранецентрированная решетка искажается и превращается в тетрагональную гранецентрированную с отношением осей с/а < 1.
При отношении < 0,41решетка может быть устойчивой, если не парные, а одиночные атомы разместить в центрах малых кубов гранецентрированной кубической решетки, т. е. в тетраэдрических пустотах.
Фазы внедрения могут растворять в себе металлические компоненты. Фазы внедрения с однотипными кристаллическими решетками образуют между собой непрерывные ряды твердых растворов (системы NbC – ТаС, NbC – TiC, NbC – ZrC, TaC – TiC, ТаС – ZrC, TiC – VC, TiC – TiN).
 2014-02-02
2014-02-02 3050
3050
