Структура газов, жидкостей и твердых тел и молекулярное движение в них
Лекция 2.
Газообразные, твердые и жидкие тела имеют разную структуру инеодинаковый характер молекулярного движения в них. Причина этого состоит в том, что структура вещества и характер молекулярного движения в нем определяются силами межмолекулярного взаимодействия, а силы взаимодействия быстро убывают с увеличением межмолекулярных расстояний.
В газах среднее расстояние между молекулами во много раз больше размеров самих молекул. Межмолекулярные силы сцепления на таких расстояниях слабы, и молекулы движутся почти независимо друг от друга, меняя направление движения при столкновениях между собой или со стенками сосуда.
В кристаллах расстояния между молекулами значительно меньше, чем в газах, а межмолекулярные взаимодействия сильнее. Поэтому характер молекулярного движения в кристаллах совершенно иной. В кристаллах молекулы, атомы или ионы (в зависимости от природы вещества) переходят с места на место сравнительно редко, колеблясь большую часть времени около некоторых неподвижных положений равновесия, или узлов. Эти узлы распределены в пространстве тем или иным закономерным образом, который определяется характером межмолекулярных взаимодействий.
Повышение температуры кристалла приводит к увеличению амплитуды колебаний составляющих его частиц, к увеличению расстояния между узлами (расширение тела при нагревании) и, следовательно, к ослаблению сил сцепления. От этого случаи оставления частицами своего узла становятся все более частыми, и при некоторой температуре, называемой точкой плавления, исчезает упорядоченность в размещении центров колебаний, решетка разрушается и кристалл плавится.
Газы и кристаллы резко отличаются друг от друга своей структурой и характером молекулярного движения. Для газов типична хаотичность, а для кристаллов — упорядоченность. В этом смысле газы и кристаллы противоположны друг другу.
В жидкостях же сочетаются свойства, типичные для газов, со свойствами, типичными для кристаллов.
Молекулы жидкости не так прочно связаны друг с другом, как молекулы кристалла, но и не так свободны, как молекулы газов; молекулы жидкости колеблются, подобно молекулам кристаллов, но положения равновесия, около которых совершаются колебания, не остаются неподвижными, как в кристаллах, а непрерывно меняются.
Таковы в самых общих чертах особенности молекулярного движения в различных агрегатных состояниях вещества.
Идеальным газом в термодинамике называется газ, подчиняющийся законам Бойля-Мариотта, Гей-Люссакаи Шарля.
Для определенного количества вещества (числа молей):
• при постоянной температуре pV = const (закон Бойля-Мариотта);
• при постоянном давлении  = const (закон Гей-Люссака);
= const (закон Гей-Люссака);
• при постоянном объеме 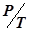 = const (закон Шарля).
= const (закон Шарля).
Здесь Т — абсолютная температура. Эти законы были установлены экспериментально.
Все три газовых закона являются следствием уравнения состояния идеального газа (уравнения Менделеева-Клапейрона):
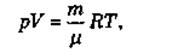
где m — масса газа; m — его молярная масса; R называется универсальной газовой постоянной
Плотность газа определяется выражением:
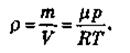
Парциальным давлением некоторого газа в смеси называется такое давление, которое создавал бы этот газ, если бы все остальные газы отсутствовали.
Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений компонентов:
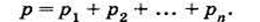
Закон Авогадро: при одинаковых значениях давления и температуры в равных объемах разных идеальных газов содержится одинаковое количество молекул.
 2014-02-02
2014-02-02 1617
1617







