Образование химических соединений обусловлено возникновением химической связи между атомами в молекулах и кристаллах.
Химическая связь - это взаимное сцепление атомов в молекуле и кристаллической решётке в результате действия между атомами электрических сил притяжения.
КОВАЛЕНТНАЯ СВЯЗЬ.
Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов. Она может быть образована атомами одного итого же элемента и тогда она неполярная; например, такая ковалентная связь существует в молекулах одноэлементных газов H2, O2, N2, Cl2 и др.
Ковалентная связь может быть образована атомами разных элементов, сходных по химическому характеру, и тогда она полярная; например, такая ковалентная связь существует в молекулах H2O, NF3, CO2. Ковалентная связь образуется между атомами элементов,
Количественные характеристики химических связей. Энергия связи. Длина связи. Полярность химической связи. Валентный угол. Эффективные заряды на атомах в молекулах. Дипольный момент химической связи. Дипольный момент многоатомной молекулы. Факторы, определяющие величину дипольного момента многоатомной моле-кулы.
|
|
|
Характеристики ковалентной связи. Важными количественными характеристиками ковалентной связи являются энергия связи, ее длина и дипольный момент.
Энергия связи - энергия, выделяющаяся при ее образовании, или необходимая для разъединения двух связанных атомов. Энергия связи характеризует ее прочность.
Длина связи - расстояние между центрами связанных атомов. Чем меньше длина, тем прочнее химическая связь.
Дипольный момент связи (m) - векторная величина, характеризующая полярность связи.
Длина вектора равна произведению длины связи l на эффективный заряд q, который приобретают атомы при смещении электронной плотности: | m | = lЧ q. Вектор дипольного момента направлен от положительного заряда к отрицательному. При векторном сложении дипольных моментов всех связей получают дипольный момент молекулы.
На характеристики связей влияет их кратность:
- энергия связи увеличивается в ряд;
- длина связи растет в обратном порядке.
Энергия связи (для данного состояния системы) — разность между энергией состояния, в котором составляющие части системы бесконечно удалены друг от друга и находятся в состоянии активного покоя и полной энергией связанного состояния системы: 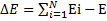 ,
,
где E — энергия связи компонентов в системе из N компонентов (частиц), Еi — полная энергия i-го компонента в несвязанном состоянии (бесконечно удалённой покоящейся частицы) и E — полная энергия связанной системы. Для системы, состоящей из бесконечно удалённых покоящихся частиц энергию связи принято считать равной нулю, то есть при образовании связанного состояния энергия выделяется. Энергия связи равна минимальной работе, которую необходимо затратить, чтобы разложить систему на составляющие её частицы.
|
|
|
Она характеризует стабильность системы: чем выше энергия связи, тем система стабильнее. Для валентных электронов (электронов внешних электронных оболочек) нейтральных атомов в основном состоянии энергия связи совпадает с энергией ионизации, для отрицательных ионов — со сродством к электрону. Энергии химической связи двухатомной молекулы соответствует энергия её термической диссоциации, которая составляет порядка сотен кДж/моль. Энергия связи адронов атомного ядра определяется в основном сильным взаимодействием. Для лёгких ядер она составляет ~0,8 МэВ на нуклон.
Длина химической связи — расстояние между ядрами химически связанных атомов. Длина химической связи — важная физическая величина, определяющая геометрические размеры химической связи, её протяжённость в пространстве. Для определения длины химической связи используют различные методы. Газовую электронографию, микроволновую спектроскопию, спектры комбинационного рассеяния и ИК спектры высокого разрешения применяют для оценки длины химических связей изолированных молекул в паровой (газовой) фазе. Считается, что длина химической связи является аддитивной величиной, определяемой суммой ковалентных радиусов атомов, составляющих химическую связь.
Полярность химических связей — характеристика химической связи, показывающая изменение распределения электронной плотности в пространстве вокруг ядер в сравнении с распределением электронной плотности в образующих данную связь нейтральных атомах. Можно количественно оценить полярность связи в молекуле. Трудность точной количественной оценки состоит в том, что полярность связи зависит от нескольких факторов: от размеров атомов и ионов соединяющихся молекул; от числа и характера связи уже имевшихся у соединяющихся атомов до их данного взаимодействия; от типа структуры и даже особенностей дефектов их кристаллических решёток. Такого рода расчёты производятся различными методами, которые в общем-то дают примерно одинаковые результаты (величины).
Например, для HCl установлено, что на каждом из атомов в этой молекуле имеется заряд, равный 0,17 заряда целого электрона. На водородном атоме +0,17, а на атоме хлора −0,17. В качестве количественной меры полярности связи чаще всего используются так называемые эффективные заряды на атомах. Эффективный заряд определяется как разность между зарядом электронов, находящимся в некоторой области пространства вблизи ядра, и зарядом ядра. Однако эта мера имеет лишь условный и приблизительный [относительный] смысл, поскольку невозможно однозначно выделить в молекуле область, относящуюся исключительно к отдельному атому, а при нескольких связях — к конкретной связи.
Валентный угол — угол, образованный направлениями химических (ковалентных) связей, исходящими из одного атома. Знание валентных углов необходимо для определения геометрии молекул. Валентные углы зависят как от индивидуальных особенностей присоединенных атомов, так и от гибридизации атомных орбиталей центрального атома. Для простых молекул валентный угол, как и другие геометрические параметры молекулы, можно рассчитать методами квантовой химии. Экспериментально их определяют из значений моментов инерции молекул, полученных путем анализа их вращательных спектров. Валентный угол сложных молекул определяют методами дифракционного структурного анализа.
ЭФФЕКТИВНЫЙ ЗАРЯД АТОМА, характеризует разность между числом электронов, принадлежащих данному атому в хим. соед., и числом электронов своб. атома. Для оценок Э. з. а. используют модели, в к-рых экспериментально определяемые величины представляют как функции точечных неполяризуемых зарядов, локализованных на атомах; напр., дипольный момент двухатомной молекулы рассматривают как произведение Э. з. а. на межатомное расстояние. В рамках подобных моделей Э. з. а. можно рассчитать, используя данные оптич. или рентгеновской спектроскопии.
|
|
|
Дипольные моменты молекул.
Идеальная ковалентная связь существует лишь в частицах, состоящих из одинаковых атомов (Н2, N2 и т.д.). Если образуется связь между различными атомами, то электронная плотность смещается к одному из ядер атомов, то есть происходит поляризация связи. Характеристикой полярности связи служит ее дипольный момент.
Дипольный момент молекулы равен векторной сумме дипольных моментов ее химических связей. Если полярные связи расположены в молекуле симметрично, то положительные и отрицательные заряды компенсируют друг друга, и молекула в целом является неполярной. Так происходит, например, с молекулой диоксида углерода. Многоатомные молекулы с несимметричным расположением полярных связей являются в целом полярными. Это относится, в частности, к молекуле воды.
На результирующее значение дипольного момента молекулы может повлиять неподеленная пара электронов. Так, молекулы NH3 и NF3 имеют тетраэдрическую геометрию (с учетом неподеленной пары электронов). Степени ионности связей азот − водород и азот − фтор составляют 15 и 19%, соответственно, а их длины - 101 и 137 пм, соответственно. Исходя из этого, можно было бы сделать вывод о большем дипольном моменте NF3. Однако эксперимент показывает обратное. При более точном предсказании дипольного момента следует учитывать направление дипольного момента неподеленной пары (рис. 29).

Концепция гибридизации атомных орбиталей и пространственное строение молекул и ионов. Особенности распределения электронной плотности гибридных орбиталей. Основные типы гибридизации: sp, sp2, sp3, dsp2, sp3d, sp3d2. Гибридизация с участием неподеленных электронных пар.
|
|
|
ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ.
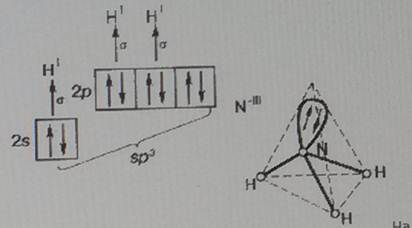
Для объяснения строения некоторых молекул в методе ВС применяется модель гибридизации атомных орбиталей (АО). У некоторых элементов (бериллий, бор, углерод) в образовании ковалентных связей принимают участие как s-, так и p-электроны. Эти электроны расположены на АО, различающихся по форме и энергии. Несмотря на это связи, образованные с их участием, оказываются равноценными и расположены симметрично.
В молекулах ВеС12, ВС13 и СС14, например, валентный угол С1-Э-С1 равен 180, 120, и 109.28 о. Значения и энергии длин связей Э-С1 имеют для каждой из этих молекул одинаковое значение. Принцип гибридизации орбиталей состоит в том, что исходные АО разной формы и энергии при смешении дают новые орбитали одинаковой формы и энергии. Тип гибридизации центрального атома определяет геометрическую форму молекулы или иона, образованного им.
Рассмотрим с позиций гибридизации атомных орбиталей строение молекулы. 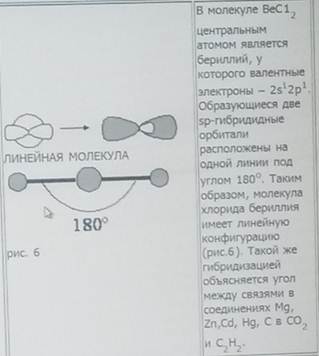
Пространственная форма молекул.
Формулы Льюиса многое говорят об электронном строении и устойчивости молекул, но пока ничего не могут сказать об их пространственном строении. В теории химической связи существуют два хороших подхода к объяснению и предсказанию геометрии молекул. Они хорошо согласуются между собой. Первый подход называется теорией отталкивания валентных электронных пар (ОВЭП). Несмотря на “страшное” название, суть этого подхода очень проста и понятна: химические связи и неподеленные электронные пары в молекулах стремятся расположиться как можно дальше друг от друга. Поясним на конкретных примерах. В молекуле BeCl2 есть две связи Be-Cl. Форма этой молекулы должна быть такой, чтобы обе эти связи и атомы хлора на их концах располагались как можно дальше друг от друга:
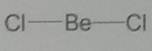
Это возможно только при линейной форме молекулы, когда угол между связями (угол ClBeCl) равен 180о.
Другой пример: в молекуле BF3 имеется 3 связи B-F. Они располагаются как можно дальше друг от друга и молекула имеет форму плоского треугольника, где все углы между связями (углы FBF) равны 120 о:
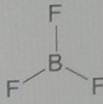
Гибридизация атомных орбиталей.
В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары. Например, молекула воды содержит две ковалентные химические связи между атомом кислорода и рисунок 21 двумя атомами водорода (рис. 21).
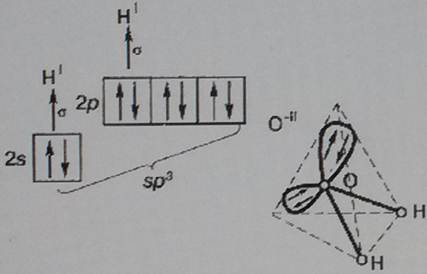
Помимо двух пар электронов, общих с атомами водорода, у атома кислорода имеются две пары внешних электронов, не участвующих в образовании связи (неподеленные электронные пары). Все четыре пары электронов занимают определенные области в пространстве вокруг атома кислорода. Поскольку электроны отталкиваются друг от друга, электронные облака располагаются на возможно большем расстоянии друг от друга. При этом в результате гибридизации меняется форма атомных орбиталей, они вытянуты и направлены к вершинам тетраэдра. Поэтому молекула воды имеет угловую форму, а угол между связями кислород-водород равен 104,5 o.

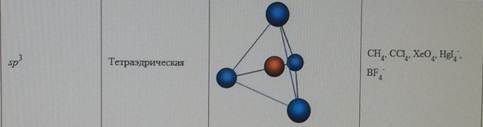
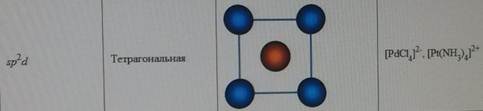
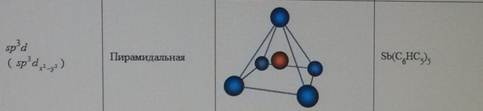
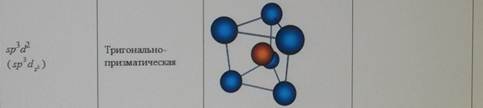
Форма молекул и ионов типа АВ2, АВ3, АВ4, АВ5, АВ6. d-АО, участвующие в образовании σ-связей в плоских квадратных молекулах, в октаэдрических молекулах и в молекулах, построенных в форме тригональной бипирамиды. Влияние отталкивания электронных пар на пространственную конфигурацию молекул (концепция участия неподеленных электронных пар КНЭП).
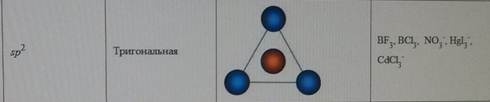
Форма молекул и ионов типа АВ2, АВ3, АВ4, АВ5, АВ6. Каждому виду гибридизации АО соответствует строго определенная геометрическая форма, подтвержденная экспериментально. Ее основу создают σ-связи, образованные гибридными орбиталями, в их электростатическом поле движутся делокализованные пары π-электронов (в случае кратных связей) (табл. 5.3). sp-гибридизация. Подобный тип гибридизации возникает при образовании атомом двух связей за счет электронов, находящихся на s- и p-орбиталях и обладающих близкой энергией. Этот тип гибридизации характерен для молекул типа АВ2(рис. 5.4). Примеры таких молекул и ионовприведены в табл. 5.3 (рис. 5.4).
Таблица 5.3
Геометрические формы молекул

Е – неподеленная электронная пара.
Структура молекулы BeCl2. Атом бериллия имеет в нормальном состоянии во внешнем слое два спаренных s-электрона. В результате возбуждения один из s электронов переходит в p-состояние – появляются два неспаренных электрона, отличающиеся формой орбитали и энергией. При образовании химической связи они преобразуются в две одинаковые sp-гибридные орбитали, направленные под углом 180 градусов друг к другу.
Be 2s2 Be 2s1 2p1 – возбужденное состояние атома
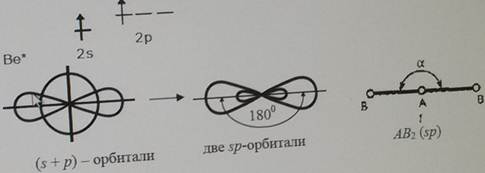
Рис. 5.4. Пространственное расположение sp-гибридных облаков
Основные виды межмолекулярных взаимодействий. Вещество в конденсированном состоянии. Факторы, определяющие энергию межмолекулярных взаимодействий. Водородная связь. Природа водородной связи. Количественные характеристики водородной связи. Меж- и внутримолекулярная водородная связь.
МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ - взаимод. молекул между собой, не приводящее к разрыву или образованию новых хим. связей. М. в. определяет отличие реальных газов от идеальных, существование жидкостей и мол. кристаллов. От М. в. зависят мн. структурные, спектральные, термодинамич. и др. св-ва в-в. Появление понятия М. в. связано с именем Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостей предложил в 1873 ур-ние состояния, учитывающее М. в. Поэтому силы М. в. часто называют ван-дер-ваальсовыми.
Основу М. в. составляют кулоновские силы взаимод. между электронами и ядрами одной молекулы и ядрами и электронами другой. В экспериментально определяемых св-вах в-ва проявляется усредненное взаимод., которое зависит от расстояния R между молекулами, их взаимной ориентации, строения и физ. характеристик (ди-польного момента, поляризуемости и др.). При больших R, значительно превосходящих линейные размеры самих молекул, вследствие чего электронные оболочки молекул не перекрываются, силы М. в. можно достаточно обоснованно подразделить на три вида-электростатические, поляризационные (индукционные) и дисперсионные. Электростатичные силы иногда называют ориентационными, однако это неточно, поскольку взаимная ориентация молекул может обусловливаться также и поляризац. силами, если молекулы анизотропны.
При малых расстояниях между молекулами (R ~ l) различать отдельные виды М. в. можно лишь приближенно, при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные переносу электронного заряда. Несмотря на нек-рую условность, такое деление в каждом конкретном случае позволяет объяснять природу М. в. и рассчитать его энергию.
Строение вещества в конденсированном состоянии.
В зависимости от расстояния между частицами, составляющими вещество, и от характера и энергии взаимодействия между ними вещество может находиться в одном из трех агрегатных состояний: в твердом, жидком и газообразном.
При достаточно низкой температуре вещество находится в твердом состоянии. Расстояния между частицами кристаллического вещества составляют порядка размера самих частиц. Средняя потенциальная энергия частиц больше их средней кинетической энергии. Движение частиц, составляющих кристаллы, весьма ограниченно. Силы, действующие между частицами, удерживают их в близи равновесных положений. Этим объясняется наличие у кристаллических тел собственных формы и объема и большое сопротивление сдвигу.
При плавлении твердые вещества переходят в жидкость. По структуре жидкое вещество отличается от кристаллического тем, что не все частицы находятся друг от друга на тех же расстояниях, что и в кристаллах, часть молекул отдалена друг от друга на большие расстояния. Средняя кинетическая энергия частиц для веществ в жидком состоянии примерно равна их средней потенциальной энергии.
Твердое и жидкое состояния часто принято объединять общим термином - конденсированное состояние.
Типы межмолекулярных взаимодействий внутримолекулярная водородная связь. Связи, при образовании которых перестройка электронных оболочек не происходит, называются взаимодействием между молекулами. К основным видам взаимодействия молекул следует отнести ван-дер-ваальсовы силы, водородные связи и донорно-акцепторное взаимодействие.
При сближении молекул появляется притяжение, что обуславливает возникновение конденсированного состояния вещества (жидкого, твердого с молекулярной кристаллической решеткой). Силы, которые способствуют притяжению молекул, получили название ван-дер-ваальсовых.
Они характеризуются тремя видами межмолекулярного взаимодействия:
а) ориентационное взаимодействие, которое проявляется между полярными молекулами, стремящимися занять такое положение, при котором их диполи были бы обращены друг к другу разноименными полюсами, а векторы моментов этих диполей были бы ориентированы по одной прямой (по-другому оно называется диполь-дипольное взаимодействие);
б) индукционное, которое возникает между индуцированными диполями, причина образования которых является взаимная поляризация атомов двух сближающихся молекул;
в) дисперсионное, которое возникает в результате взаимодействия микродиполей, образующихся за счет мгновенных смещений положительных и отрицательных зарядов в молекулах при движении электронов и колебаний ядер.
Дисперсионные силы действуют между любыми частицами. Ориентационное и индукционное взаимодействие для частиц многих веществ, например: He, Ar, H2, N2, CH4, не осуществляется. Для молекул NH3 на дисперсионное взаимодействие приходится 50 %, на ориентационное – 44,6 % и на индукционное – 5,4 %. Полярная энергия вандерваальсовых сил притяжения характеризуется невысокими значениями. Так, для льда она составляет 11 кДж/моль, т.е. 2,4 % энергии ковалентной связи H-O (456 кДж/моль). Вандерваальсовы силы притяжения – это физические взаимодействия.
Водородная связь – это физико-химическая связь между водородом одной молекулы и ЭО элементом другой молекулы. Образование водородных связей объясняется тем, что в полярных молекулах или группах поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой ЭО и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома. Как показывают спектральные данные, в образовании водородной связи существенную роль играет также и донорно-акцепторное взаимодействие ЭО атома как донора и атома водорода как акцептора. Водородная связь может быть межмолекулярной или внутримолекулярной.
Водородные связи могут возникать как между различными молекулами, так и внутри молекулы, если в этой молекуле имеются группы с донорной и акцепторной способностями. Так, именно внутримолекулярные водородные связи играют основную роль в образовании пептидных цепей, которые определяют строение белков. Одним из наиболее известных примеров влияния внутримолекулярной водородной связи на структуру является дезоксирибонуклеиновая кислота (ДНК). Молекула ДНК свернута в виде двойной спирали. Две нити этой двойной спирали связаны друг с другом водородными связями. Водородная связь имеет промежуточный характер между валентным и межмолекулярным взаимодействием. Она связана с уникальными свойствами поляризованного атома водорода, его малыми размерами и отсутствием электронных слоев.
Межмолекулярная и внутримолекулярная водородная связь.
Водородные связи обнаружены во многих химических соединениях. Они возникают, как правило, между атомами фтора, азота и кислорода (наиболее электроотрицательные элементы), реже - при участии атомов хлора, серы и других неметаллов. Прочные водородные связи образуются в таких жидких веществах, как вода, фтороводород, кислородсодержащие неорганические кислоты, карбоновые кислоты, фенолы, спирты, аммиак, амины. При кристаллизации водородные связи в этих веществах обычно сохраняются. Поэтому их кристаллические структуры имеют вид цепей (метанол), плоских двухмерных слоев (борная кислота), пространственных трехмерных сеток (лед).
Если водородная связь объединяет части одной молекулы, то говорят о внутримолекулярной водородной связи. Это особенно характерно для многих органических соединений (рис. 42). Если же водородная связь образуется между атомом водорода одной молекулы и атомом неметалла другой молекулы (межмолекулярная водородная связь), то молекулы образуют довольно прочные пары, цепочки, кольца. Так, муравьиная кислота и в жидком и в газообразном состоянии существует в виде димеров:
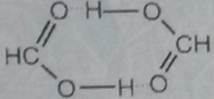
а газообразный фтороводород содержат полимерные молекулы, включающие до четырех частиц HF. Прочные связи между молекулами можно найти в воде, жидком аммиаке, спиртах. Необходимые для образования водородных связей атомы кислорода и азота содержат все углеводы, белки, нуклеиновые кислоты. Известно, например, что глюкоза, фруктоза и сахароза прекрасно растворимы в воде. Не последнюю роль в этом играют водородные связи, образующиеся в растворе между молекулами воды и многочисленными OH-группами углеводов.
Периодический закон. Современная формулировка периодического закона. Периодическая система химических элементов – графическая иллюстрация периодического закона. Современный вариант Периодической системы. Особенности заполнения электронами атомных орбиталей и формирование периодов. s-, p-, d-, f- Элементы и их расположение в периодической системе. Группы, периоды. Главные и побочные подгруппы. Границы периодической системы.
Открытие Периодического закона.
Основной закон химии - Периодический закон был открыт Д.И. Менделеевым в 1869 году в то время, когда атом считался неделимым и о его внутреннем строении ничего не было известно. В основу Периодического закона Д.И. Менделеев положил атомные массы (ранее - атомные веса) и химические свойства элементов.
Расположив 63 известных в то время элемента в порядке возрастания их атомных масс, Д.И. Менделеев получил естественный (природный) ряд химических элементов, в котором он обнаружил периодическую повторяемость химических свойств.
Например, свойства типичного металла литий Li повторялись у элементов натрий Na и калий K, свойства типичного неметалла фтор F - у элементов хлор Cl, бром Br, иод I.
У некоторых элементов Д.И. Менделеев не обнаружил химических аналогов (например, у алюминия Al и кремния Si), поскольку такие аналоги в то время были еще неизвестны. Для них он оставил в естественном ряду пустые места и на основе периодической повторяемости предсказал их химические свойства. После открытия соответствующих элементов (аналога алюминия - галлия Ga, аналога кремния - германия Ge и др.) предсказания Д.И. Менделеева полностью подтвердились.
 2015-01-30
2015-01-30 15513
15513
