Характеристической функцией называется такая функция состояния системы, посредством которой или ее производных могут быть выражены в явной форме термодинамические свойства системы. Наиболее широко в термодинамике используются следующие пять характеристических функций: изобарно-изотермический потенциал, изохорно-изотермический потенциал, внутренняя энергия, энтальпия и энтропия.
Первые четыре из них объединяются также общим названием термодинамических потенциалов. Впрочем, этот термин применяют нередко и в более узком смысле, обозначая им только оба изотермических потенциала или даже только первый из них.
Для процессов, происходящих при постоянной температуре, можно получить для конечного изменения:
А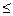 = T (S 2- S 1)-(U 2- U 1)
= T (S 2- S 1)-(U 2- U 1)
или
А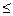 =(U 1- ТS 1)-(U 2- ТS 2) (1.11)
=(U 1- ТS 1)-(U 2- ТS 2) (1.11)
Здесь, как и прежде, знак равенства относится к обратимому процессу и определяет, следовательно, максимальную работу А М. Последнее соотношение показывает, что в изотермических условиях максимальная работа процесса А М может рассматриваться как разность значений функции (U — TS) в начальном и в конечном состояниях системы.
Функция (U — TS) играет большую роль при изучении равновесия в изотермических процессах. Ее называют изохорно-изотермическим потенциалом (сокращенно — просто изохорным потенциалом) или энергией Гельмгольца. Мы будем обозначать ее через F:
F = U - TS (1.12)
При этом для всякого изотермического процесса
dF = dU - TdS
Δ F =Δ U - T Δ S (1.13)
и максимальная работа в изотермическом процессе
А М= –Δ F (1.14)
Изменения энтропии, как мы видели, определяют направление и предел течения самопроизвольных процессов для изолированных систем. Подобно этому наша новая функция определяет их для систем, находящихся при постоянных температуре и объёме.
Близкой к изохорному потенциалу является функция, определяющая направление и предел самопроизвольного протекания процессов для систем, находящихся при постоянных температуре и давлении. Эта функция называется изобарно-изотермическим потенциалом (сокращенно — изобарным потенциалом), или энергией Гиббса, обозначается через G и определяется как
G = H - TS (1.15)
Или
G = U - TS + pV (1.16)
а также
G = F + pV (1.17)
т.е. G находится в таком же отношении к функции F, как энтальпии Н к внутренней энергии U.
Для любого процесса Δ G =Δ F +Δ(pV).
Для изобарного процесса отсюда следует:
Δ G =Δ F + p Δ V (1.18)
Для всякого изотермического процесса
dG = dH-TdS
Δ G =Δ H-T Δ S (1.19)
Максимальной полезной работой А М′ изотермического процесса называют величину
А М′=–Δ G (1.20)
Согласно уравнениям (1.14 и 1.18):
А М′= А М– p Δ V (1.21)
т.е. максимальная полезная работа А М′ равна максимальной работе А М за вычетом работы против внешнего давления.
Ввиду полной аналогии в свойствах обоих изотермических потенциалов F и G в дальнейшем мы будем их рассматривать параллельно.
Полные дифференциалы этих функций определяются соотношениями:
dF = dU - TdS - SdT (1.22)
dG = dU - TdS - SdT + pdV + Vdp (1.23)
Подставив в них выражение dU, получим:
dF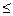 – SdT – pdV (1.24)
– SdT – pdV (1.24)
dG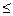 – SdT + Vpd (1.25)
– SdT + Vpd (1.25)
Здесь, как и раньше, знак равенства относится к равновесиям и к обратимым процессам, а неравенства — к необратимым. Эти соотношения показывают, что для изохорно-изотермических процессов, т. е. при dV=0 и dT=0
dF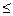 0 (1.26)
0 (1.26)
а для изобарно-изотермических процессов, т.е. при dp =0 и dT =0
dG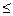 0 (1.27)
0 (1.27)
Следовательно, в системах, находящихся при постоянных температуре и объеме, самопроизвольно могут протекать только те процессы, которые сопровождаются уменьшением F, причем пределом их протекания, т.е. условием равновесия, является достижение некоторого минимального для данных условий значения функции F, т.е. условие
dF=0
d2F>0 (1.28)
В системах же, находящихся при постоянных температуре и давлении, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением G, причем пределом их протекания, т.е. условием равновесия служит достижение некоторого минимального для данных условий значения функции G, т.е. условие
dG =0
d 2 G >0 (1.29)
Все это не означает, конечно, что процессы, сопровождающиеся возрастанием G, не могут происходить при постоянной температуре и давлении. Но такие процессы происходят лишь по мере получения работы извне, например путем электролиза или с помощью электрического разряда в газах (что требует затраты и обоих случаях электрической энергии) или действием света в фотохимических реакциях. В частности, так происходит фотосинтез в растениях.
Возможность самопроизвольного течения процесса и состояние равновесия в системах, находящихся при других условиях, определяются изменением других термодинамических величин.
Сабақтын қысқаша мазмұны
Термодинамиканың екінші бастамасы кез-келген процестің белгілі бір бағытта жүруінің критерийі болып табылады. Қарастырылатын жүйенің берілген температура, қысым, концентрацияда өздігінен жүру мүмкіндігін, осы кезде пайда болатын жұмыстың мөлшерін, процестің өздігінен жүру мүмкіндігінің шегі қандай, яғни берілген жағдайларда тепе-тендіктің күйі қандай екенін термодинамиканың ΙΙ-заңы анықтайды.
Осыдан әрі екінші бастама біз қарастыратын процесс, бізге керекті бағытта және қажетті дәрежеде жүру үшін қандай сыртқы жағдайлар керек екенін анықтауға мүмкіндік береді. Екінші заң арқылы процесс жүру үшін қажетті жұмыстың шамасын және бұл мөлшердің сыртқы жағдайларға тәуелділігін анықтауға болады.
Осының барлығы физикалық химияның теориялық мәселелерін зерттеумен қатар, қолданбалық сипаттағы әртүрлі тапсырмаларды шешу үшін де маңызды.
 2014-02-02
2014-02-02 3245
3245
