Регуляция белкового обмена
Авторегуляция проявляется в том, что при увеличении в рационе белковой пищи происходит постепенная активация ферментов желудочно – кишечного тракта, активация тканевых ферментов, участвующих в катаболизме белков и аминокислот.
Нервная регуляция подтверждается тем, что денервация мышечной ткани резко снижает синтез белков в ней, а при интенсивной мышечной работе происходит усиление синтеза мышечных белков.
Эндокринная регуляция осуществляется при участии гормонов гипофиза, щитовидной, поджелудочной, половых желез, надпочечников.К гормонам, которые уменьшают распад тканевых белков и активируют их синтез, относятся соматотропин, физиологические концентрации гормонов щитовидный, андрогены, инсулин. Распад тканевых белков активируют высокие концентрации гормонов щитовидной железы. В соединительной, лимфоидной ткани распад белков усиливают глюкокортикоиды.
У новорожденных развивается физиологическая транзиторная гипопротеинемия - снижение концентрации белка в плазме крови. Она связана с усиленным распадом белков и использованием их на энергетические нужды в период неонатальной адаптации.
Нарушение обмена серосодержащих аминокислот: смотри обмен серосодержащих аминокислот
Нарушение обмена фенилаланина, тирозина: смотри обмен фенилаланина и тирозина
Нарушение синтеза мочевины: смотри биосинтез мочевины
Белковое голодание может наблюдаться при недостатке белков в рационе, недостатке витаминов, заболеваниях желудочно–кишечного тракта. При белковом голодании усиливается распад собственных тканевых белков, особенно в таких тканях как мышцы, печень и плазма крови. Развивается отрицательный азотистый баланс, дистрофия мышц, нарушение антитоксической функции печени, гипопротеинемия и как следствие, «голодные» отёки. Происходит уменьшение подкожной клетчатки, страдают иммунные процессы. Тяжелая форма белкового голодания носит название квашиоркор (красный ребёнок).
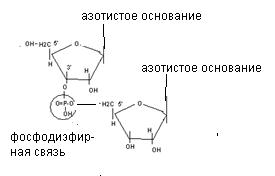
Нуклеиновые кислоты – высокомолекулярные полимерные соединения, мономером которых являются мононуклеотиды.
Мононуклеотиды включают в свой состав три вещества: азотистое основание, углевод (рибоза или дезоксирибоза), фосфорную кислоту. Различают 2 вида азотистых оснований: пуриновые (производные пурина) и пиримидиновые (производные пиримидина).
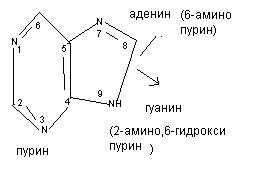
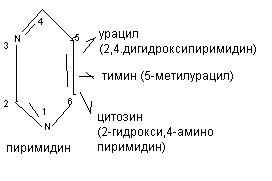
Азотистые основания соединяются с углеводом β - N- гликозидной связью. Пуриновое основание соединяется с углеводом за счёт 9 атома азота, а пиримидиновое - за счёт 1 атома азота. К углеводу фосфоэфирной связью присоединяется фосфорная кислота.
В зависимости от количества остатков фосфорной кислоты различают нуклеозидмонофосфаты (цикло-АМФ, ФАФС, S-аденозилметионин), нуклеозиддифосфаты (УДФ-глюкоза, ЦДФ-холин), нуклеозидтрифосфаты (макроэрги).
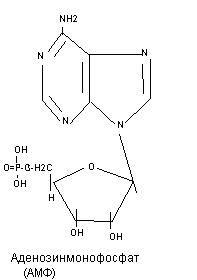
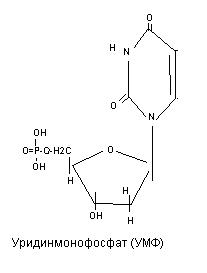
Нуклеотиды соединяются в полинуклеотидную цепь фосфодиэфирными связями, образованными фосфорной кислотой и рибозой соседних нуклеотидов (к рибозе одного нуклеотида фосфорная кислота присоединяется в третьем положении, а к рибозе соседнего нуклеотида - в пятом положении).
Рибонуклеиновые кислоты (РНК)
Все виды РНК состоят из одной полинуклеотидной цепи. Азотистые основания в РНК представлены аденином, гуанином, урацилом, цитозином. Углевод представлен рибозой. Различают несколько видов РНК.
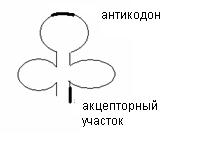
Транспортные РНК (тРНК ) осуществляют транспорт аминокислот на рибосомы, к месту синтеза белка. Молекулярная масса тРНК составляет около 30 000 дальтон. Полинуклеотидная цепь тРНК включает в свой состав 70-80 нуклеотидов. На долю тРНК приходится около 15% всего запаса РНК клетки. В тРНК содержится большое количество минорных нуклеотидов. Между комплементарными нуклеотидами участков тРНК возникают водородные связи, и формируется её вторичная структура в виде трилистника (форма «клеверного листа»). В составе тРНК выделяют 2 важных функциональных участка. На средней петле располагается антикодон, комплементарный кодонам иРНК, на открытом конце – акцепторный участок, к которому присоединяется аминокислота. Для переноса каждой аминокислоты в клетках имеется «своя» тРНК.
тРНК имеет 3-ю структуру, которая представляет собой компактное наложение петель друг на друга.
Различают изоакацепторные тРНК, которые переносят одну и ту же аминокислоту, но отличаются одним нуклеотидом в антикодоне.
Рибосомальные РНК (рРНК) составляют до 80% всей РНК клетки. Рибосомальная РНК локализована в рибосомах и обеспечивает биосинтез белка. Рибосома человека имеет молекулярную массу 80S, включает большую субъединицу массой 60S (включает РНК с массой 5S, 5-8S, 25S) и малую субъединицу с массой 40S (включает РНК массой 18S). Вторичная структура рРНК представляет компактную укладку, формирующую овальный каркас большой и малой субъединиц, соединённый с белками.
Информационная РНК (иРНК ) имеет большую молекулярную массу около 106 дальтон. На её долю приходится около 3% РНК клетки. В первичной структуре иРНК представлены кодоны, среди которых различают инициирующие (в них первый нуклеотид А), терминирующие (в них первый нуклеотид У) и кодоны, определяющие порядок аминокислот в синтезируемом белке. На одном конце иРНК имеется «шапочка - кеп», необходимая для связывания иРНК с малой субъединицей рибосомы в начале синтеза белка. На другом конце полинуклеотидной цепи располагается полиадениловый «хвост», выполняющий защитную функцию. 
 2014-02-02
2014-02-02 1942
1942
