Т
нуклеиновые кислоты. Рибосомы необходимы для биосинтеза белков. Полисомы - это
образования в клетке, состоящие из вытянутой молекулы м-РНК, окруженной
рибосомами.
Вирусы можно выделять в кристаллической форме, они не имеют своей ферментной
системы. Вирус - это упакованная одно- или двухцепочечная молекула ДНК или РНК,
окруженная белковой оболочкой. Инфицирование клетки имеет место, когда внутрь нее
проникает либо целый вирус или только ДНК (РНК). Последние перестраивают
метаболизм клетки, таким образом, что энергия и вновь образованные метаболиты
используются для биосинтеза новых вирусных частиц.
Липопротеины (ЛП). Различают свободные ЛП, выполняющие транспортную роль, они
отличаются значительным количеством гидрофобных аминокислот, высших жирных
кислот, которые присоединяются к цепи за счет сложноэфирных связей, способностью
функционировать в гидрофобном окружении.
В крови обнаружено несколько форм ЛП, такие как хиломикроны, липопротеины очень
низкой плотности (ЛОНП), ЛП низкой плотности (ЛНП), ЛП высокой плотности (ЛВП).
Поверхностная часть ЛП образована слоем фосфолипидов и белками. ФЛ
гидрофильными концами образуют наружную поверхность, а гидрофобные растворены
внутри частицы. ЛП синтезируются в клетках слизистой оболочки кишечника
(хиломикроны, ЛОНП), гепатоциты - ЛОНП, ЛНП, плазма крови - ЛНП,ЛВП (для
транспорта холестерина).
Хромопротеины. В этих соединениях простетическая группа представлена окрашенными
веществами, например, гем, порфирин, каротиноид, витамины.
Некоторые особенности строения миоглобина и гемоглобина
НЬ состоит из простого белка глобина и 4 молекул гема. При объединении глобина и тема получается сложное соединение, которое выполняет в организме исключительно важную дыхательную функцию. Другое важное свойство - поддержание постоянства рН крови. НЬ обеспечивает до 50% буферной ёмкости крови. НЬ - аллостерический белок, присоединение какого-либо вещества к нему меняет его сродство к другим. Он обладает способностью легко взаимодействовать с рядом газов: ОА, СОА, СО, NO, NQ. Кинетика связывания кислорода миоглобином и гемоглобином
В отличие от НЬ миоглобин имеет 1 ППЦ, которая связана с гемом. Миоглобин не способен переносить кислород от лёгких к периферическим тканям по своей химической природе. Он преобладает в мышцах и является веществом, которое эффективно запасает кислород. % или степень насыщения миоглобина Од, зависит от концентрации О2 в среде, окружающей молекулы белка. [О2] обозначается как парциальное давление в мм рт.ст. Зависимость между (О2) в среде и насыщенностью миоглобина О2, описывается в виде прямоугольной гиперболы. Кривая насыщения миоглобина и гемоглобина кислородом.
Для выяснения кинетики насыщения О2 миоглобина и НЬ необходимо принимать во внимание, что Р О2(в лёгких) = 100мм рт.ст., поэтому миоглобин в лёгких мог бы весьма эффективно насыщаться О2,. В венозной крови Р О2 составляет 40мм рт.ст., а в активно работающей мышце - 20мм рт.ст. Даже при таких параметрах миоглобин будет в значительной степени насыщаться О2, поэтому МЬО2 не может являться средством доставки O2 от лёгких к периферическим тканям. При тяжёлой мышечной работе Ро2 может понизиться до 5, при этих условиях МЬО2 легко отдаёт О2, который используется для окислительного биосинтеза АТФ в митохондриях мышечных клеток.
НЬ связывает 4 молекулы О2, на 1 тетрамер (по одной молекуле на гем в каждой субъединице). Кривая насыщения носит сигмоидный характер. Т.о. способность НЬ связывать О2 зависит от того содержатся ли в данном тетрамере другие молекулы О2,. Как видно из изотермы адсорбции связывание первой молекулы О2, протекает медленно, другой - с большей скоростью и т.д. Такой характер кинетики объясняется так называемым кооперативным связыванием, благодаря которому НЪ легко насыщается О2 в легких (при Ро2 = 100мм рт.ст.) и очень легко отдает О2, в периферических тканях (Р50 ~20мм рт.ст.). Для характеристики кинетики действия НЬ введён показатель P50 (значение РО2, при котором происходит 50%-ное насыщение, у теплокровных Р50 может значительно варьировать, однако оно всегда выше значения \ в периферических тканях). Оксигенирование НЬ сопровождается значительными изменениями конформации молекул:
1. разрыв солевых связей, образованных концевыми карбоксилами субъединиц, что
облегчает присоединение О2,
2. разрыв связи обуславливает изменение вторичных, третичных, четвертичных
структур, при этом происходит компактизация тетрамеров и увеличивается
сродство к О2
3. четвертичная структура НЬ описывается как Т - состояние для частично
оксигенированного НЬ и как R-состояние для полностью оксигенированного НЬ.
«Т- и R-состояние» используют для характеристики четвертичной структуры многих аллостерических ферментов, в Т-состоянии отмечается наименьшее сродство к субстрату. НЬ ускоряет транспорт СО2 от ткани к лёгким =15% СО2 крови переносится НЬ.
Гемаглобинопатии
Обусловлены наличием аномального НЬ. У них изменяется одно из трёх свойств:
1. растворимость
2. сродство к О2
3. устойчивость к денатурации.
1). НЬ с изменённой растворимостью. HbS - серповидно-клеточный, в Б-цепях НЬ в 6 положении заменяются аминокислотные остатки, изменяется форма, повышается ломкость, укорачивается продолжительность жизни ЭЦ.
Талассемии - нарушение синтеза цепи НЬ. а - талассемия - а - цепи, b-b- (3 - цепей, следовательно изменяется продукция эритроидных клеток в костном мозге и насыщение ЭЦНЬ.
2). Метгемоглобин - в нём железо трехвалентно
Восстановление метНЬ в нормальный происходит с участием витамина С и фермента НАДФН - метгемоглобинредуктазы. Развивается при:
а), отравлениях NO3,Br-, NО-2, анилином, особая опасность: нитратсодержащая вода для
новорожденных,
б), наследственный дефицит фермента метгемоглобинредуктазы.
Карбоксигемоглобин. Сродство НЬ человека к СО в 200 раз выше,чем к О2, т.к. СО
вытесняет О2 из оксиНЬ, при отравлении СО на коже и в тканях жертвы проявляется
ярко-вишнёво-розовый цвет
ФЕРМЕНТЫ
Характеристика.
Ферменты - биокатализаторы, ускоряющие скорость химических реакций в организме, в
реакциях не расходуются, катализируют как прямую, так и обратную реакции,
катализируют не более 1 хим. реакции, увеличивают скорость хим. реакции при обычной
температуре, обладают высокой степенью специфичности, могут регулироваться. С
термодинамической точки зрения ускоряют реакции за счет снижения энергии
активации, путем увеличения числа активированных молекул, становятся реакционно
способными на более низком энергетическом уровне.
Энергия активации - энергия, необходимая для перевода всех молекул 1 моля вещества в
активированное состояние при данной температуре.
Классификация. Номенклатура.
Название: 1. субстрат 2. тип катализируемой реакции с окончанием «аза»
Классы ферментов (в основе классификации лежит специфичность ферментов).Для
некоторых используются тривиальные названия (пепсин, трипсин).
1. оксидоредуктазы (ОВР)
НАД, ФАД '
2. трансферазы (перенос отдельных групп атомов кроме Н от одной молекулы к другой)
Аминотрасфераза
3. гидролазы (гидролиз пептидных, эфирных связей с участием воды - ферменты ЖКТ)
4. лиазы (отщепление групп от субстрата без воды с образованием двойных связей, или
присоединение групп по = связи)
Амидинлиаза, фумаратгидротаза
5. изомеразы (взаимопревращение изомеров)
Рацемаза
5. лигазы или синтетазы (образование связей в реакциях конденсации у различных
соединений с использованием энергии АТФ или витамина Н(биотин))
Глутаминсинтетаза
Все ферменты - глобулярные белки, состоящие из одной или нескольких ППЦ в
третичной структуре. Имеют активный центр (АЦ) - это участок, образованный
боковыми радикалами аминокислотных остатков, отдаленных друг от друга, которые на
уровне третичной структуры формируют центр. К нему присоединяется субстрат,
который обладает пространственным и химическим сродством к нему
(комплиментарностью).
Субстрат - это лиганд или вещество, которое подвергается химической модификации
при взаимодействии с АЦ фермента.
АЦ содержит якорный участок, который не играет каталитической роли, а служит для
специфического связывания субстрата; каталитический центр, который участвует в
химической модификации. Кроме АЦ в молекуле фермента может присутствовать
аллостерический центр (регуляторный), при помощи него осуществляется регуляция
активности фермента.
Аллостерический центр содержат ферменты, состоящих из нескольких субъединиц, эти
ферменты являются ключевыми в различных метаболических путях. Часто молекулы
фермента содержат небелковый компонент, от которого зависит его активность -
кофактор. Комплекс белковой части и кофактора называют холоферментом. К
кофакторам относят: ионы металлов и коферменты (орг.соединения).
Более 25% ферментов прочно связаны с ионами металлов.
Различают:
1. металлоферменты - содержат ионы металлов, имеющих функциональное значение,
которые в ходе очистки не отделяются от фермента
2. ферменты, активируемые металлами - связаны с металлом менее прочно, но для
проявления активности фермента необходимо добавление металла в среду.
В отличие от ионов металлов коферменты участвуют в химической реакции. Коферменты являются переносчиками различных групп и их рассматривают как второй субстрат. Коферменты претерпевают химические превращения, противоположные тем, которые происходят с субстратом (в ОВР субстрат окисляется, а кофермент -восстанавливается).
Механизм действия ферментов. Основные черты
ферментативного катализа, его этапы.
При ферментативном катализе фермент обратимо соединяется с субстратом, в результате образуется нестойкий ферментсубстратный комплекс (ES).
На первых этапах носит обратимый, а затем необратимый характер. Потом распадается на фермент и продукт реакции.
Е +S<-------------------à E S* --------à Eр -------à Е+ р
Так как ES существует, в течение конечного промежутка времени может быть и так, что все молекулы фермента связаны в ES (при условии, что концентрация субстрата высокая - субстрат в избытке) — говорят о максимальной скорости ферментативной реакции. Теория Фишера подразумевает жёсткое соответствие между активным центром и субстратом («ключ» - «замок»), т.е. каталитический центр заранее подготовлен к форме субстрата.
Теория Кошланда (теория индуцированного соответствия). Подразумевает гибкость каталитического центра, т.е. каталитически активная конформация фермента и субстрата может возникать в момент присоединения субстрата, до него геометрическое соответствие АЦ и субстрата приблизительное.
 |
 |
Гипотеза индуцированного соответствия предполагает между ферментом и субстратом
не только геометрического соответствия, но и электрическое.
Основные черты:
1. АЦ формируется из участков ППЦ и отдельных аминокислотных остатков. Субстрат соединяется с АЦ в нескольких точках, это обеспечивает высокую избирательность связывания (комплиментарность субстрата и АЦ) и ориентацию субстрата, необходимую для катализа.
2. АЦ составляет небольшую часть молекулы фермента, располагается в углублении
(нише) поверхности фермента. Ниша - гидрофобная. Субстрат, соединяясь с АЦ,
оказывается не в водной среде, а в специфическом окружении функциональных
групп АЦ.
3. В ходе присоединения субстрата и в ходе катализа происходят конформационные
изменения молекулы фермента и субстрата, до взаимодействия конформации
соответствуют лишь незначительно. Строгая комплиментарность возникает при
взаимодействии в результате изменения конформации (индуцированное
соответствие)
Конформационные изменения могут способствовать «растягиванию», разрыву связи или сближению молекул в реакциях синтеза, тем самым, ускоряя реакцию. Специфичность.
1. субстратная (структура АЦ комплиментарна только 1 субстрату) Пример: АЦ
фермента гистидаза комплиментарен гистидину и катализирует его превращения.
2. групповая (катализируют однотипные превращения сходных по строению
веществ). Пример: липаза гидролизует жиры с различными жирными кислотами.
3. стереоспецифичность (превращение лишь одного из стереоизомеров). Пример:
цис-изомер фумаровой кислоты - малеиновая кислота не может быть субстратом
для фумаразы.
Единица ферментативной активности (с. 157)
За единицу фермента принимают такое его количество, какое катализирует превращение
1 ммоль вещества за 1 мин.[1 Ед].
Удельная активность фермента — число единиц фермента на массу белка в мг. В образце.
Молярная активность указывает сколько молекул субстрата превращает 1 моль фермента
за 1 минуту (число оборотов).
Регуляция активности ферментов. Выделяют 4 типа регуляции:
1. Частичный протеолиз (Трипсиноген------àТрипсин)
4. Аллостерическая (фосфофруктокиназа, изицитратдегидрогеназа)
«Ферменты - основа жизни» (Павлов)
В обмене веществ ферменты играют первостепенную роль. В основе заболеваний лежит изменение какой-либо ферментативной реакции, если ингибировать хотя бы 1 фермент наступает смерть.
Факторы, оказывающие влияние на активность ферментов.
1. Биологические: вид (животное), если человек, то учитывается пол и возраст,
физиологическое состояние организма, условия питания, окружающая среда и
эмоциональные факторы.
2. Физико-химические: концентрация фермента и, главным образом, субстрата,
температуры, рН и ингибиторы. Наибольший клинический интерес представляет
температура, рН и ингибиторы.
 |
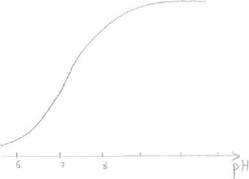
При низкой концентрации субстрата и последующем её увеличении зависимость между [субстрата] и V прямо пропорциональна. Дальнейшее увеличение концентрации субстрата приводит к снижению скорости, и наконец, наступает такое значение концентрации субстрата, после которой скорость ферментативной реакции остаётся неизменной. Это называется эффектом насыщения фермента субстратом. Для характеристики кинетики в ферментативных реакциях была вычислена константа Михаэлиса - Ментен (Michaelis&Menten), которая выражается: Km= (E)*(S)-(ES)/(ES)
По сути дела Km составляет l/2Vmax.
Для того, чтобы определить скорость реакции можно пользоваться уравнением:
V=Vmax*(S)/(S)+Km
Концентрация фермента не оказывает влияния на процесс.
2). Температура
Ферменты имеют белковую природу и являются термолабильными. В некотором
ограническом интервале температур (от 0°до 25° С) скорость ферментативной реакции
повышается, с ростом температуры (на 10°С) скорость повышается примерно в 2 раза.
При дальнейшем повышении температуры скорость реакции постепенно понижается,
высокие температуры приводят к денатурации фермента - белка и необратимой утрате
ферментативной активности. Для большинства ферментов оптимум температурный
приближается к нормальной температуре тела.
В первые часы повышенной температуры вырабатывается фермент интерферон,
выполняющий защитные функции. Пониженные температуры используют в
трансплантации, искусственном оплодотворении.
Растительные ферменты менее чувствительны к температуре.
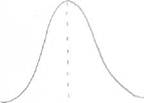
3). Влияние рН на активность ферментов.
а) значение рН, которое соответствует максимальной активности фермента,
необязательно совпадает со значением рН, характерным для нормального внутри - и
внеклеточного окружения этого фермента;
б) всё-таки большинство ферментов имеют оптимум рН, близкий к рН окружающей
среды;
в) у многих ферментов оптимум рН приближается к ИЭТ;
г) для каждого фермента существует своё значение рН, при котором он проявляет
максимальную активность;
д) «Значение рН внутри клетки является, возможно, одним из самых важных элементов
регуляции клеточного метаболизма».
 |
 Пепсин
Пепсин
ТРИПСИН
/
 |
| -41- |
Согласно теории шведского учёного Сёренсена, влияние рН на активность ферментов определяется:
1) величина рК (константа диссоциации) ионизированных групп активного
центра фермента, которые участвуют в связывании субстрата;
2) величинами рК ионизированных групп самого субстрата;
3) величинами рК функциональных групп фермента, которые отвечают за
катализ;
4) величинами рК других участков молекул ферментов (аллостерические
центры)
4). активаторы и ингибиторы.
Активирование или ингибирование различных ферментов веществами эндогенного и экзогенного происхождения является значимым фактором регуляции обмена веществ. Ингибиторы подразделяются на обратимые и необратимые. В свою очередь обратимое ингибирование бывает 3-ёх видов: аллостерическое, конкурентное и неконкурентное. Примером необратимого ингибирования может быть действие высоких температур, резкое изменение рН, приводящее к денатурации фермента или действие тяжёлых металлов, соединений мышьяка, которые связываются с ферментом или с фермент-субстратным комплексом в АЦ или блокируют функциональные группы молекул фермента, удаленных от АЦ. В наибольшей степени ингибирующему действию тяжелых металлов подвергаются тиоловые ферменты.
Диизопропилфторфосфат - это вещество образует сложный эфир с остатком серина в молекуле ацетилхолинэстеразы. Вследствие этого утрачивается способность нейрона проводить нервные импульсы (относится к сильным нервнопаралитическим средствам). Терапевтическое действие аспирина связано с ингибированием одного из ферментов, участвующего в биосинтезе простогландинов (обладает гормональными свойствами, является клеточным метаболитом).
Конкурентное ингибирование.
Механизм такого ингибирования в общих чертах связан с тем, что химическая природа ингибитора близка к химической природе субстрата.
Например, активность сукцинатдегидрогиназы может быть подавлена низкомолекулярными дикарбоновыми кислотами, например, щавелевой или пропандиовой кислотами.
 Сукцинат
Сукцинат ФУМАРАТ
ФУМАРАТ
Возникает комплекс фермент-ингибитор. Конкурентное ингибирование может быть снято путём увеличения концентрации субстрата.
Для внутриклеточных процессов характерно обратимое ингибирование. Конкурентное ингибирование.
1. Зависит от концентрации субстрата
2. Ингибитор является структурным аналогом субстрата, конкурируя с субстратом за
АЦ, при повышении концентрации одного из этих компонентов уменьшается
вероятность связывания другого (при повышении концентрации субстрата, он
может полностью вытеснить ингибитор из АЦ).
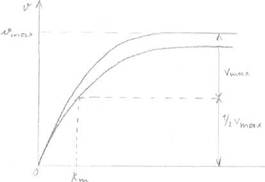
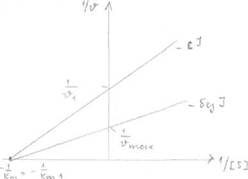
Конкурентное и неконкурентное ингибирование легко различить по графикам
Лайнуивера-Берка.
Графики представляют собой зависимость обратной скорости (1/Vo) от обратной
концентрации субстрата (1/[S]).
 |
| Чем выше точка А, тем Vo меньше. |
 ^ "vn«".*
^ "vn«".*
При бесконечно большой [S] скорость ферментативной реакции не меняется (т.А), т.к. при этом происходит полное вытеснение ингибитора из АЦ большими концентрациями субстрата, Km при этом увеличивается (т.к. она зависит от [S], а она здесь увеличивается).
Неконкурентное ингибирование.
Ингибитор по структуре не похож на субстрат, не конкурирует с субстратом за АЦ, а присоединяется в другом центре - аллостерическом, при этом происходит уменьшение максимальной скорости ферментативной реакции, a Km остаётся неизменной, т.к. не зависит от [фермента].
Уменьшение Vmax происходит потому, что при помощи ингибитора из ферментативной реакции выводятся молекулы фермента, меньше молекул фермента, меньше Vmax. График Лайнуивера-Берка выглядит следующим образом:
 |
Ингибитор присоединяется к аллостерическому центру, изменяет конформацию
фермента—» АЦ
2 фермента выводится из реакции —> V [.
Биохимия нуклеотидов и нуклеиновых кислот. Матричные биосинтезы.
Вопросы:
1. структура нуклеотидов-мономеров нуклеиновых кислот. Структура азотистых
оснований - пуриновых (А, Г) и пиримидиновых (У, Т, Ц). Нумерация атомов в
азотистых основаниях, в рибозе и дезоксирибозе (с.98)
- нумерация в пуриновых и пиримидиновых основаниях ведется в противоположном направлении, С5 находится в одном и том же положении
2. Отличие нумерации в рибозе и дезоксирибозе
3. Связи в нуклеотидах (с. 102) (эфирная, B-N-гликозидная)
4. Принцип названия нуклеотидов (5)
5. Первичная структура нуклеиновых кислот (связи между нуклеотидами) (с.101-105)
6. Отличия в нуклеотидах ДНК и РНК (с.97, 101)
7. Вторичная структура ДНК (с. 108), где находится ДНК, правило Чаргаффа, модель
Уотсона и Крика; основные черты модели (4), каким образом образуются водородные
связи между цепями ДНК (с. 108)
8. Структура и функции РНК (с. 100), ш-РНК (с.516), м-РНК (с.518), р-РНК (с.513)
Биологически важные производные нуклеотидов (моно- и динуклеотидов).
АТФ - аденозинтрифосфорная кислота - основной внутриклеточный переносчик
свободной энергии.
[АТФ] ~ 1 ммоль/л. По структуре - это аденозин с тремя остатками фосфорной кислоты в
пятом положении пентозы. При гидролизе 1 моля АТФ высвобождается 7 ккал энергии.
В результате катаболизма (ферментативное разрушение белков, жиров, углеводов,
поступающих с пищей). Энергия из химических связей накапливается путём
фосфорилирования АДФ и АТФ, которая затем в процессах анаболизма используется за
счёт обратной реакции (АТФ=АДФ+Ф).
АТФ необходима для биосинтеза веществ, мышечного сокращения, функционирования
K/Na насосов, т.е. активного транспорта.
В АТФ очень легко разрушаются связи между остатками фосфорной кислоты с
выделением большого количества энергии - макроэргические связи.
Кроме АТФ переносчиками энергии являются:
ГТФ и АТФ - биосинтез белка;
АТФ и УТФ - биосинтез полисахаридов;
АТФ и ЦТФ, дАТФ, дГТФ, дТТФ, дЦГФ - в биосинтезе ДНК.
цАМФ-3,5-аденозинмонофасфат-медиатор внеклеточных сигналов (например,
гормонов). Образуется из АТФ под действием фермента аденилатциклазы.
цГМФ-антагонист цАМФ.
Производные урациловых участвуют в качестве коферментов в различных реакциях
метаболизма гексоз и синтезе гликогена, например, уридиндифосфатлюкоза -
предшественник в синтезе гликогена, УТФ используется в реакциях превращения
галактозы в глюкозу.
Некоторые нуклеозиды 5 - фосфаты выполняют роль переносчиков молекул, например,
КоА является производным нуклеотида, переносит ацильные группы и ацетильные
радикалы, содержит витамин - пантотеновую кислоту.
Производные нуклеотидов: ФАД, НАД, не являются продуктами гидролиза нуклеиновых
кислот, а синтезируются самостоятельно и являются производными витаминов.
НАД - никотинамидадениндинуклеотид, производное витамина РР,
ФАД - флавинадениндинуклеотид, производное витамина В;
функции: связующие звенья между процессами анаболизма и катаболизма. Содержат
аденозин-5-фосфат, переносят 2Н=2р+ё
ФАДН2,- восстановленная форма ФАД+.
НАДН + Н+"- т.к. этот кофермент переносит не 2 атома Н, а гидрид-ион (2ё и 1р).
Матричные биосинтезы. Основными матричными биосинтезами являются:
1. биосинтез ДНК или репликация (матрица - уже существующая молекула ДНК);
2. биосинтез РНК с использованием матрицы ДНК - это транскрипция;
3. биосинтез белков (трансляция) с использованием в качестве матрицы матричной
РНК.
Репликация ДНК.
Механизм: спираль раскручивается, цепь расходится, а затем каждая одноцепочечная половина ДНК достраивается до целой двухцепочечной по принципу комплиментарности, в результате получается 2 двухцепочечные молекулы ДНК -полуконсервативный способ.
Консервативный способ когда вновь синтезированная цепь образуется без раскручивания.
Характеристика репликации.
Субстратами для репликации служат дезоксирибонуклеозидфосфаты (дАТФ, дЦТФ, дГТФ, дТТФ).
Источники энергии - дАТФ, дГТФ, дТТФ, дЦТФ.
Репликация ДНК всегда идет с образованием репликативной вилки, синтез идет в направлении 5—»3. В синтезе принимает участие мультиферментный репликативный комплекс.
Ферменты: эндонуклеазы, ДНК - раскручивающие белки, ДНК-полимеразы (а,δ,β, ε), ДНК - лигаза, РНК - праймаза.
Продукты реакции - вновь синтезированные молекулы ДНК идентичны матрице, репликация идет в двух направлениях, обе цепи реплицируются одновременно, протекает в S фазу клеточного цикла. Полная репликация генома происходит за 9 часов -время необходимое для удвоения генетического материала диплоидной делящейся клетки —> репликация начинается в нескольких местах с образованием «репликативного глаза».
Если точка репликации находится в начале «репликативного глаза», то репликация идет в одном направлении.
Если точка репликации находится в середине «репликативного глаза», то репликация идет в двух направлениях, но цифровое сохраняется.
Образование репликативных вилок начинается с образования «репликативного глаза». Для бактерий и вирусов «репликативный глаз» образуется там, где имеются специфические нуклеотидные последовательности (около 300 нуклеотидов) - это точки начала репликации. В точке начала репликации эндонуклеаза (топоизомераза) вызывает кратковременный разрыв 1 цепи ДНК (это топоизомераза 1) или двухцепочечный разрыв (топоизомераза 2) и присоединяется к разорванному концу, способствуя расплетению небольшого участка спирали. В дальнейшем раскручивании ДНК принимают участие спецефические белки - ДНК-геликазы (рис.2), использующие АТФ (АТФ-зависимые ДНК-геликазы).
Другие белки образуют репликативную вилку - дестабилизирующие белки (рис.2), которые выстраиваются в ряды на образовавшейся одноцепочечной ДНК, растягивают её остов и делают основания нуклеотидов более доступными для спаривания. Для того чтобы репликативная вилка могла продвигаться вперёд со скоростью равной 50 нуклеотидов в секунду, родительская спираль должна вращаться 50 оборотов в секунду. Этого не происходит, т.к. при действии топоизомеразы образуется шарнирный участок, т.е. временный разрыв цепи, возникающий под её действием, даёт возможность спирали ДНК по обе стороны от него вращаться.
Синтез, растущей дочерней цепи идёт в направлении 5—>3, осуществляется ДНК-полимеразой (ДНК-полимераза 5 осуществляет синтез лидирующей цепи, е, а, р -отстающей), осуществляющей полимеризацию нуклеотидов по принципу комплиментарности. Рис.2
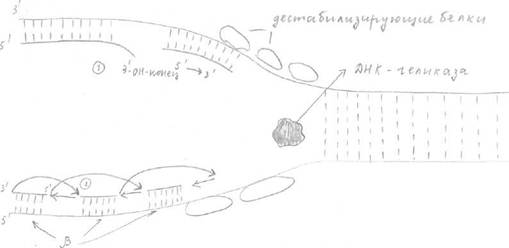
Ведущая цепь синтезируется следующим образом:
Синтез начинается с синтеза затравки (т.к. ДНК-полимераза может только достраивать нуклеотиды к имеющимся 3-ОН-концам). Затравка или праймер (от 10 до 200 нуклеотидов) состоит из нуклеотидов РНК и синтезируется РНК-праймазой. 3-ОН-конец праймера должен быть спарен с матричной цепью. Если 3-ОН-конец не спарен с нуклеотидами матричной цепи, тогда ДНК-полимеразы отщепляет неспаренные нуклеотиды до появления спаренного конца (1) (рис.2).
ДНК-полимераза 5 достраивает дочернюю цепь, прикрепляя к праймеру 5-конец (2). Синтез на ведущей цепи протекает быстро. Синтез отстающей цепи происходит особенным образом, т.к. если бы он проходил также, как на ведущей цепи, направление синтеза было бы 3—>5 (рис.2), а ДНК-полимеразы осуществляет "синтез новой дочерней цепи в направлении 5^------>3^ —> особенности: - отстающая дочерняя цепь синтезируется фрагментами (5;
- для каждого фрагмента нужен свой праймер. От каждого праймера синтезируются в
нужном направлении фрагменты от 1000 до 2000 нуклеотидов у прокариот, у эукариот -
100-200- фрагменты Оказаки.
- для синтеза фрагментов Оказаки ДНК-полимеразе (а) необходимо ~ 4с, после этого
она осуществляет синтез следующего фрагмента.
Каждый раз нужна новая затравка (из 10 нуклеотидов). Затравки синтезируются с
определенным интервалом (3) на матрице, затем их наращивает ДНК-полимераза с 3-
конца, начиная всякий раз новые фрагменты Оказаки, до тех пор, пока не достигнет
РНК-затравки, присоединенной к 5-концу предыдущего фрагмента (4).
Затем ДНК-полимераза р удаляет затравки между фрагментами Оказаки и достраивает
нуклеотидную цепь из нуклеотидов ДНК. Завершает процесс ДНК-лигаза, которая
соединяет З'-фрагмент нового фрагмента ДНК с 5-концом предыдущего.
Таким образом, в целом цепь строится в направлении 3^-»5,' но каждый фрагмент
синтезируется в нужном направлении 5—»3 по типу шитья назад.
Транскрипция. Трансляция.
Заключается в переводе информации, заключенной в последовательности нуклеотидов матричной-РНК, в последовательность аминокислот в белке, т.е. матрицей для синтеза белка является матричная РНК.
Субстраты - аминокислоты, источники энергии - АТФ и ГТФ. Биосинтез белка - циклический процесс:
1. инициация
2. элонгация
3. терминация
Для вступления в биосинтез аминокислоты должны быть активированы. Активация
аминокислот - образование аминоацил-m-PHK (аминокислота своей СООН-группой
присоединяется к 3-ОН-группе акцепторного участка т-РНК).
Происходит это при помощи специфических ферментов (для каждой аминокислоты -
свой фермент).
Аминоацил-m-PHK синтетаза (участвует в реакции активации аминокислот)
Молекулы т-РНК являются адаптерами.
 1).Инициация
1).Инициация
Заключается в формировании белоксинтезирующего мультиферментного комплекса
рибосомы.
Рис.1
 |
В начале особая инициирущая аминоацил-m-PHK, несущая у эукариот Met, у прокариот
- формил Met, присоединяется к малой субъединице рибосомы.
 Затем этот комплекс присоединяется к матричной
Затем этот комплекс присоединяется к матричной
РНК в специальном стартовом кодоне по принципу
комплиментарности, матричная РЕК удерживается
в специальной бороздке. Затем к малой субъединице
присоединяется большая (состоящая из А- и Р-участков), так что инициирующая аминоацил-m-PHK оказывается в Р-участке, А-участок свободен. Р-пептидил-m-PHK -связывающий, А-аминоацильный (рис.2)
В процессе инициации принимают участие белковые факторы инициации. Фактор инициации 3 катализирует связывание матричной-РНК с малой субъединицей рибосомы. Фактор инициации 2 взаимодействует с инициирующей т-РНК и ГТФ и в присутствии фактора инициации 1 присоединяет т-РНК к первому кодону матрицы. Образуется инициирующий комплекс. Факторы высвобождаются, после этого к ГТФ присоединяется большая субъединица, при этом происходит гидролиз ГТФ.
2). Элонгация
Заключается в наращивании ППЦ от NH2 - к СООН-концу. Циклический процесс. Включает 3 этапа (идет в присутствии факторов элонгации):
1. связывание аминоацил-m-PHK, несущей другую аминокислоту;
2. образование пептидной цепи;
3. транслокация рибосомы.
На первом этапе молекула аминоацил-m-PHK, несущая любую аминокислоту, связывается со свободным А-участком, с комплиментарным кодоном матричной-РНК. А- и Р- участки расположены близко друг к другу так, что 2 связанные аминоацил-m-PHK спариваются с двумя соседними ко донами (фактор элонгации 1, 1 молекула ГТФ)
На втором этапе происходит расщепление макроэргической связи между т-РНК и
аминокислотой, находящейся в Р-участке (рис.1) и засчет энергии разрыва этой связи в
присутствии воды образуется пептидная связь между свободными СООН-концом
аминокислотой Р-участка и NH2 —группой аминокислоты в А-участке
(пептидилтрансфераза прочно связан с рибосомой).
Дополнительной энергией АТФ и ГТФ не требуется для синтеза пептидной связи, т.к.
используется энергия макроэргической связи —> в Р-участке т-РНК становится
свободной, а растущая ППЦ прикреплена к т-РНК в А-участке.
На третьем этапе происходит транслокация или перемещение рибосомы на один кодон с
затратой энергии АТФ (фактор элонгации 2) в направлении 5— >3 т-РНК с растущей
ППЦ переносится в Р-участок, а свободная аминокислота — в цитоплазму.
3). Терминация
Рибосома перемещается до тех пор, пока не встретит стоп ко доны: УАА, УАГ, УГА. К
ним нет аминоацил-m-PHK. Вместо этого в А-участок присоединяется особый белок -
фактор освобождения - это изменяет активность фермента и он присоединяет к
растущему СООН-концу воду —> карбоксильный конец отделяется от т-РНК и
синтезированная цепь уходит в цитоплазму.
Рибосома распадается, ППЦ отделяется.
Антибиотики, бактериальные токсины - ингибиторы матричных биосинтезов.
Энергетический обмен и общие пути катаболизма. Вопросы:
1. связь обмена веществ с обменом энергии. Понятие об ОВР.
2. общие пути катаболизма
б) окислительное карбоксилирование ПВК
в) молекулярная организация митохондриальной ЦПЭ
г) синтез АТФ. Хемоосметическая теория Митчелла.
3. ингибиторы дыхательной цепи и разобщители окислительного фосфорилирования 1. обмен веществ включает в себя 3 этапа:
1.поступление веществ в организм и расщепление основных веществ: белков, жиров, углеводов до мономеров
2.метаболизм или промежуточный обмен
3.выделение продуктов обмена.
Метаболизм состоит из двух фаз: катаболизма (расщепление сложных органических молекул до СО2, Н2О и мочевины, сопровождается выделением энергии) -экзорганические реакции и анаболизма (синтез сложных веществ (полимеров) из более простых с использованием энергии, выделяющейся при катаболизме) - эндорганические реакции.
Центральная роль в энергетическом обмене принадлежит АТФ, в макроэргических связях которой запасается энергия, выделяемая в процессе катаболизма. АТФ используется в реакциях анаболизма, для поддержания температуры тела, работы организма.
За сутки образуется ~ 60кг АТФ, запасов АТФ в клетке хватает на несколько секунд. Необходимое количество АТФ получается за счет цикла.
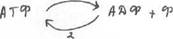
Таким образом, синтез АТФ тесно связан с процессами катаболизма. Это превращение и есть сущность энергетического обмена. В организме вещества: белки, жиры, углеводы распадаются в три стадии (рис.1)
1. внеклеточная. Протекает в ЖКТ, где белки, жиры, углеводы распадаются до
мономеров или составных частей;
2. внутриклеточная. В результате нее полученные мономеры распадаются либо до
пирувата, либо до ацетилкоа. 1 и 2 стадия являются специфическими.
3. общий конечный путь катаболизма. Для всех трех классов веществ - цикл
трикарбоновых кислот, т.к. ПВК превращается в ацетилКоА, то у нас есть 2 общих пути
катаболизма - окислительное декарбоксилирование пирувата(ПВК—>ацетилкоА) и цикл
трикарбоновых кислот (ЦТК). В результате ЦТК происходит отщепление двух атомов Н
4 раза (окисление субстратов, участие коферментов) и выделяется СО2. СО2 выделяется с
выдыхаемым воздухом, а 2 Н, отщеплённые от субстрата поступают в ЦПЭ или
митохондриальную дыхательную цепь, где в результате переноса Н образуется Н2О.
Таким образом, исходя из рис.1, конечными продуктами катаболизма являются СОд, и
HjO. Общие пути катаболизма протекают в митохондриях. Конечные продукты: СО2 и Н2
О термодинамически стабильны, содержание кислорода в них больше, чем в начальных
продуктах, т.е. реакции катаболизма связаны с реакциями окисления и потреблением О2.
Распад органических веществ в живых тканях, сопровождающийся потреблением (\ и
выделением СО2 и Цр, называется тканевым дыханием. В результате окисления веществ
или субстратов углерод окисляемых веществ включается в СО2, а потребляемый
кислород включается в молекулу H2О(за счет Н окисляемых субстратов).
Если субстрат окисляется, то это означает отщепление от него Н (дегидрирование), если субстрат восстанавливается к нему присоединяется 2 атома Н (гидрирование).
Ферменты, осуществляющие эту реакцию относятся к 1 классу и называют дегидрогеназами (участвуют коферменты НАД и ФАД, т.к. они являются переносчиками двух атомов водорода).
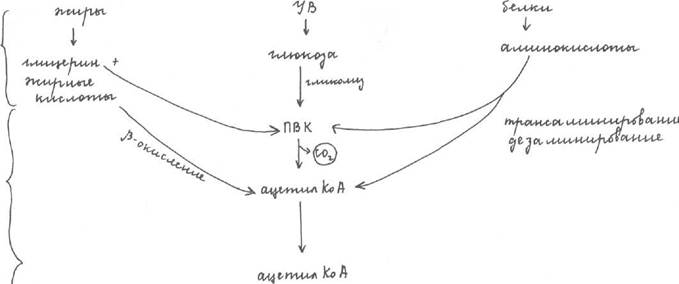
Рис.1

Название фермента при окислении — субстрат + дегидрогеназа, при восстанови продукт+дегидрогеназа. Энергия окисляющихся веществ используется для синтеза АТФ из АДФ и фосфора (неорганического). Существует 2 основных пути синтеза АТФ
1. путем окислительного фосфорилирования - синтез АТФ с участием ЦПЭ митохондриях).
2. субстратное фосфорилирование - синтез АТФ на уровне субстратов за счет энергии разрыва макроэрической связи субстрата (не требует присутствия мембран митохондрий):гликолиз, ЦТК.
Цикл трикарбоновых кислот (цикл лимонной кислоты или цикл Кребса). Значение ЦТК:
1. общий конечный путь катаболизма белков, жиров, углеводов
2. основной, но не единственный постановщик атомов Н, отщепляемых от субстратов
вЦПЭ
3. выполняет не только катаболическую роль, но и анаболическую: метаболиты ЦТК
служат предшественниками для синтеза многих веществ, например, глюкозы и
аминокислот. Протекает в митохондриях, все ферменты, кроме
сукцинатдегидрогеназы находятся в матриксе, СДГ связан с внутренней
мембраной митохондрий, АЦ его выступает в матрикс.
Сущность ЦТК.
Двухуглеродная молекула ацетилКоА взаимодействует с четырехуглеродной молекулой оксалоацетата образуется шестиуглеродная молекула лимонной кислоты (цитрата), от которой в ходе дальнейших реакций отщепляется 2С в виде СО и 4 раза протекает реакция окисления субстратов (дегидрирование или отщепление 2Н). В конечном итоге молекула оксалоацетата регинирирует и может вступать в следующий цикл, а 2 Н, отщепленные от субстрата, поступают в ЦПЭ и в сопряженном с этим процессом образуется АТФ.
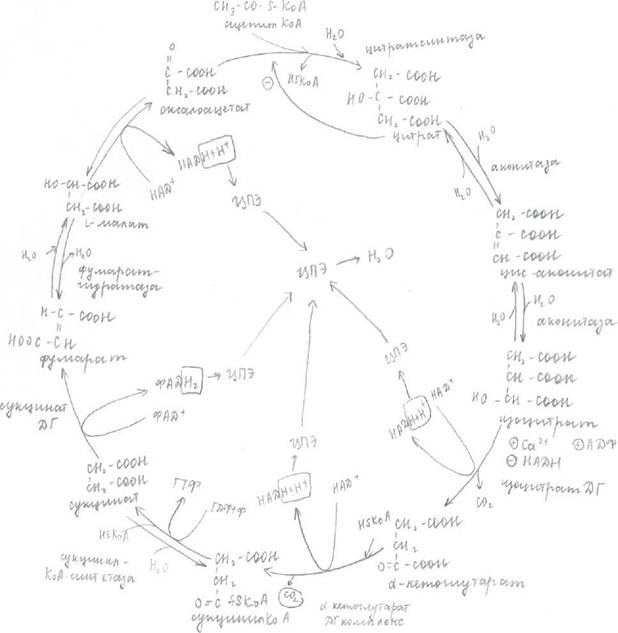
Ключевая реакция (регулируется (катализируется) аллостерическим центром) - это
реакция скорость лимитирующая.
Таким образом, в результате одного цикла 1 молекула ацетилкоА сгорает до СO2 и Н2О
(ЦПЭ)—»ЦТК и ЦПЭ - единый процесс.
Окислительное декарбоксилирование ПВК - ОДПВК - общий путь катаболизма белков,
жиров, углеводов, протекает в митохондриях, в результате образуется ацетилкоА,
который вступает в ЦТК, восстановленный кофермент НАД и CO2
Катализирует это превращение мультиферментный комплекс, состоящий из трех
ферментов и пяти коферментов.
Ферменты: Е1 - пируватдекарбоксилаза,
Е 2 - ацетилтрансфераза дегидролипоевой кислоты, Е 3 - дегидрогиназа дигидролипоевой кислоты. 5 коферментов: НАД (витамин РР)
ФАД (витамин В)
тиаминопирофосфат (ТПФ - витамин В)
КоА (витамин пантотеновая кислота)
липоевая кислота
Все ферменты объединены в пируватдегидрогеназный комплекс, аналогичный комплекс функционирует в ЦТК, при превращении а-кетоглутаровой кислоты в сукцинилКоА. В его состав входит около трех десятков ферментов Е1, около десятка (8) ЕЗ и 1 молекула Е2. Они соединены с собой таким образом, что серусодержащая часть липоевой кислоты, соединенная с Е2, способна перемещаться последовательно к АЦ Е1 и Е2 —> промежуточные продукты не успевают выходить в раствор.
При недостатке витамина В нарушается процесс ОДПВК - это приводит к накоплению лактата. Наблюдается у алкоголиков с нарушенным режимом питания или при синдроме Вернике-Корсакова. Выделяют 3 реакции:
1 реакция осуществляется с помощью Е1 - пируватдекарбоксилаза КоЕ - производное витамина В - тиаминпирофосфат.
Происходит отщепление карбоксильной группы от пирувата и перенос оставшегося ацильного остатка. СН3СОО на дегидролипоевую кислоту. Дегидролипоевая кислота является коферментом второго фермента - ацетилтрансфераза, она содержит дисульфидную группу в составе и боковую цепь, которая амидной связью соединена с Е2 (рис.1). Рис.1
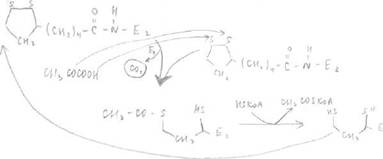 |
fa
Во второй реакции ацетильный остаток переносится на КоА при помощи фермента Е2, т.е. фермент Е2 отщепляет ацетильный остаток от собственного кофермента.
В третьей реакции происходит окисление дигидролипоата Е2 третьим ферментом -дигидролипоат Е2 дегидрогеназа.
Организация ЦПЭ (по рис.1)
Окисление субстратов в процессе дыхания можно представить как перенос ёиН (т.е. атомов Н), которые отщепляются от субстратов (например, в ЦТК и ОДПВК). Этот процесс включает несколько этапов и в нем участвует ряд переносчиков, образующих ЦПЭ. ЦПЭ локализована во внутренней мембране митохондрий. В переносе ё и Н (т.е. атомов Н) участвуют три класса окислительно-восстановительных ферментов:
1. пиридинзависимые дегидрогеназы (НАД, НАДФ)
2. флавинзависимые дегидрогеназы (ФАД,ФМН)
3. цитохромы, содержащие железопорфириновую кольцевую систему
По рис.1: первый компонент ЦПЭ - НАДН+Н-кофермент дегидрогеназ, который легко
отделяется от своего фермента и диффундирует к внутренней мембране митохондрий и
становится первым компонентом дыхательной цепи - производное витамина PP.
Второй компонент - НАДН - ДГ -белок - кофермент флавинмононуклеотид -
производное Bj,, называется так по субстрату, от которого отщепляет или отнимает 2Н
(НАДН+Н*)
Третий компонент — кофермент Q или убихинон, структура его сходна со структурой
витамина Е и К, содержание KoQ значительно превосходит содержание других
компонентов. Липофилен, может перемещаться в липидном слое мембраны
митохондрий.
Четвертый компонент - система цитохромов - это сложные белки-гемопротеины. Атом
Fe в отличие от Fe гемоглобина может менять валентность, при присоединении или
отдаче электронов.
Цитохром В и С функционируют в комплексе, обладают ферментативной активностью,
называются по субстрату, который окисляет QH - ДГ.
Пятый компонент - цитохром С - подвижный.
Цитохромы а и а3 функционируют как ферментцитохромоксидаза, в своем составе
помимо Fe содержат ионы Си/которые участвуют в передаче электронов на конечный
акцептор Ол.
Функции дыхательной цепи:
1. утилизация водорода, отщепленного от субстратов, и образование метаболической
воды,
2. разбивают свободную энергию Гиббса, выделяющуюся при переносе электронов и
Н по дыхательной цепи к Ол на порции, достаточные для сопряженного синтеза
АТФ (указаны J,)
3. ЦПЭ участвует в создании электрохимического трансмембранного протонного
градиента - движущей силы синтеза (АТФ).
Водород от субстратов (например, ЦГК или ОДПВК) (а) при помощи НАД-зависимых и
ФАД-зависимых ДГ (б) вводится соответственно или в начало (НАДН+Н1) или в
середину ЦПЭ (Q). 2 атома Н в виде 2ё и 2Н передаются на НАДН-ДГ. Q
восстанавливается и становится QH.
Пути Н и электронов расходятся, Н^выходят в матрикс и восстанавливают кислород, а
электроны передаются далее по цепи, т.к. система цитохромов переносит только
электроны. Поэтому дыхательная цепь называется ЦПЭ.
Система цитохромов может переносить только 1 электрон, поэтому существует 2 теории:
либо электроны переносятся по очереди, либо существуют 2 параллельные системы
цитохромов. Электроны передаются через всю систему цитохромов и вместе с Н+,
которые высвободились восстанавливают O2 до метаболической воды - расшифровка 1 функции.
Таким образом, главные компоненты дыхательной цепи располагаются во внутренней мембране строго определенным образом - в порядке возрастания окислительно-восстановительного потенциала. Атомы Н (в виде 2ệ и 2Н) перемещаются по цепи от более электроотрицательного компонента к более электроположительному кислороду, (способность отдавать электроны убывает от начала цепи к концу, способность присоединять электроны увеличивается).
Самый сильный восстановитель - НАДН, окислитель – O2. Электроны, поступающие в начало ЦПЭ, обладают | энергией, по мере продвижения по ЦПЭ запас энергии будет уменьшаться. Общая разность окислительно-восстановительных потенциалов между НАДН (начало) и O2 (концом) = 1,14В.
Этому соответствует разность свободной энергии Гиббса (-220кДж), этой энергии хватило бы на синтез четырех молекул АТФ, но синтезируется всего 3, остальное рассеивается в виде теплоты.
При переносе двух атомов Н, от окисленных субстратов, происходит изменение свободной энергии Гиббса на каждом этапе ЦПЭ. В дыхательной цепи есть три участка, в которых наблюдается большое ↓G (смотрите рисунок рядом с ↓ ).
Эта энергия используется для сопряженного синтеза АТФ, т.е. дыхательная цепь - это такой механизм, который позволяет высвобождать свободную энергию порциями. Если бы энергия высвобождалась единоразово, то она рассеивалась бы в виде тепла. Места сопряженного синтеза были исследованы при помощи ингибиторов дыхательной цепи (3 жирные J, показывают ингибирование) - расшифровка второй функции. Для объяснения механизма сопряжение существует хемиосмотическая теория Митчелла. Согласно которой при переносе е по дыхательной цепи, свободная энергия, выделяемая в трех участках, направленная на выталкивание Н в межмембранное пространство. На каждую пару электронов, переносимую по цепи высвобождается 3 пары Н. Наружная поверхность внутренней мембраны заряжается положительно, а внутренняя -отрицательно.
Таким образом, возникает электрохимический трансмембранный протонный градиент. Т.к. внутренняя мембрана не проницаема для протонов, следовательно, для их выталкивания необходима свободная энергия.
Создавшийся градиент Н+ заставляет их двигаться в обратном направлении из межмембранного пространства в матрикс. Существует специальный протонный канал, называемый F1 -комплексом, через который H+ возвращается из межмембранного пространства в матрикс.
F1 - комплекс - это белок, находящийся на внутренней поверхности внутренней мембраны, обращенной в матрикс (смотрите рис.2) и представляет собой протон-зависимую АТФ-синтетазу, которая преобразует энергию обратного потока Н в энергию фосфатных связей АТФ. При прохождении через F1 -комплекс 1 пары Н АТФ -синтетаза активируется и катализирует реакцию образования одной молекулы АТФ из АДФ и Ф (неорганического).
Т.к. при переносе электронов по дыхательной цепи к О2, в межмембранное пространство выталкивается 3 пары Н, то синтезируется 3 молекулы АТФ.
Таким образом, в ЦПЭ существует 3 участка сопряженного синтеза. 1 участок по рис.1 на уровне НАДН- дегидрогиназы, 2 - на уровне цитохромов В и С1, 3 - на уровне цитохромов а и аЗ.
Рис.2

Количество АТФ, которое образуется при переносе пары электронов в дыхательной
цепи, называется дыхательным коэффициентом Р/О. Если электроны переносятся с
начала цепи, образуется 3 молекулы АТФ, в результате сопряженного процесса, который
называется окислительным фосфорилированием (окисление ЦПЭ — фосфорилирование в
F1 -комплексе). Если электроны вводятся в цепь на уровне убихинона при помощи
ФАД-зависимых ДГ. (см. рис.2), то дыхательная цепь укорочена. Электроны проходят
всего 2 сопряженных участка, следовательно, Р/О будет равен 2.
Т.к. только в двух местах происходит выталкивание пары Н и они только дважды
активируют АТФ-синтетазу—» синтезируется всего 2 молекулы АТФ.
Разобщители окислительного фосфорилирования разобщают перенос электронов по цепи
и фосфорилирования в F1-комплексе (ионофоры и протонофоры).
Например, 2,4 -динитрофенол — это липофильное вещество, которое может свободно
проникать через мембрану митохондрий и переносить Hf из межмембранного
пространства в матрикс. То есть не возникает протонного градиента —» не синтезируется
АТФ, а вся энергия, которая выделяется при переносе электронов по ЦПЭ рассеивается в
виде тепла, так называемый пирогенный эффект, потому что повышается температура
тела.
Пирогенным эффектом обладают гормоны щитовидной железы. Валиномицин (ионофор)
действует также, но имеет сродство к К+
Дыхательный контроль.
Зависимость дыхания в митохондриях от концентрации АДФ называется дыхательным контролем, т.е. скорость синтеза АТФ путем окислительного фосфорилирования определяется потребностью клеток в энергии. При расходовании АТФ повышается концентрация АДФ в клетке —► ускоряется дыхание и фосфорилирование, т.е. синтез АТФ.
Таким образом, клеточное дыхание включает в себя следующие процессы: ОДПВК, ЦТК и ЦПЭ.
Токсичное действие кислорода. Защита от
токсичного действия кислорода.
О2 является неотъемлимой частью для нормальной деятельности организма, но О2 может образовывать высокоактивные формы, токсичные для организма. Т.к. О2 имеет 2 не спаренных электрона с одинаково ориентированными спинами, занимающие самостоятельные внешние орбитали. Присоединение одного электрона к О2 приводит к
образованию супероксидного аниона (O2). Присоединение второго электрона приводит к образованию пероксидного аниона (O22-).
О^может действовать как окислитель и как восстановитель. В результате присоединения электронов к О2 образуется НО.
O2-+ẽ+2H+ à H2O
О2 может служить восстановителем, тогда образуется О^
O2 - - ẽ à O2
Возможна ситуация, когда один Од является окислителем, а другой - восстановителем, в результате образуется перекись водорода (пероксид) - малотоксичное для клеток вещество
O2- + O2- + 2Н+ à H2O2 +O2(дисмутация)
Образовавшийся H2O2 может восстанавливаться О2 с образованием свободного гидроксильного радикала ОН, Ог и Н2О - это высокоактивные вещества, они могут взаимодействовать с нуклеиновыми кислотами, белками, липидами, лучше всего изучено их повреждающие действие на липидный слой мембраны (курс биорганики). В результате их действия повреждаются жирные кислоты, входящие в состав липидов, особенно этот процесс опасен для эритроцитов (это приводит к гемолизу - выходу содержимого эритроцитов). Поэтому организм выработал механизмы, защиты от токсичного действия кислорода (естественная защита), ферментативная.
1. во всех клетках содержится 2 фермента: 1 - супер-оксиддисмутаза - фермент,
катализирующий реакцию дисмутации; 2 - каталаза, разлагает малотоксичную перекись
до воды, т.е. эти два фермента защищают организм от накапления О2 и Н2О2
2. глутатионпероксидаза, находится больше всего в эритроцитах и в печени. Защищает
мембраны эритроцитов от разрушения, но работает в комплексе с другими ферментами.
Он катализирует восстановление перекиси водорода с образованием воды.
(Восстановление - присоединение двух атомов водорода), донорами двух атомов
водорода служат глутатион (трипептид, состоящий из глутаминовой кислоты, цистиина
и глицина).
3. витамин Е - экзогенная защита, токоферол.
Он способен окисляться, т.е. отдавать один электрон с образованием малоактивного свободного радикала. Акцепторами электрона могут быть свободные радикалы жирных кислот (которые образуются в результате перекисного окисления липидов мембран). Т.е. витамин Е восстанавливает свободные радикалы жирных кислот и прерывает цепную реакцию перекисного окисления (антиоксидантная функция витамина Е).
Включает в себя катаболизм (расщепление углеводов пищи и выделение энергии) и анаболизм (синтез углеводов с затратой энергии). Катаболизм УВ включает в себя 3
стадии:
1 стадия: углеводы пищи (суточная потребность 400-500г, самая большая, т.к. глюкоза является основным источником энергии) расщепляется до моносахаридов: глюкозы, галактозы и фруктозы (до мономеров). Расщепление внеклеточное, происходит в ЖКТ.
2 стадия: внутриклеточное расщепление глюкозы протекает в процессе гликолиза с
образованием ПВК.
3 стадия: ОДПВК, ЦТК и ЦПЭ - внутримитохондриально.
Глюкоза расщепляется в ПФП (пентозофосфатный путь) - прямое расщепление глюкозы
- энергия не выделяется, функция не энергетическая.
Функции углеводов.
1. энергетическая
2. рецепторная
3. защитная
4. пластическая
Переваривание и всасывание углеводов.
Лишь малая часть углеводов растительной пищи доступна для питания человека, из-за отсутствия соответствующих ферментов. Не перевариваются гемицеллюлозы, целлюлозы, ксиланы, пектины и др. тем не менее они имеют биохимическую функцию и физиологическое значение. Некоторые пентозаны гидролизуются и преобразуются ферментами микрофлоры толстого кишечника с образованием CO2,; С2Н5ОН и органических кислот, что стимулирует перистальтику. Кроме этого, растительные пектины и целлюлозы обладают сорбционно активными свойствами и способны выводить из организма различные токсины.
Основными углеводами растительной и животной пищи являются крахмал и гликоген, соответственно. Крахмал представляет собой смесь двух фракций полисахаридов: неразветвленной амилозы и разветвленного амилопектина.
В прямых цепях крахмала глюкозные остатки соединены между собой а-1,4-гликозидглюкозными связями (фермент а-амилаза).
В точках ветвления связи 1,6 - для гидролиза, которых нужны специальные ферменты. Гликоген имеет большую молекулярную массу, чем крахмал и разветвлен в значительно большей степени. (В его гидролизе принимают участие те же ферменты). Гидролиз данных полисахаридов начинается в ротовой полости под действием амилазы слюны. Значимость этого процесса во многом не ясна, многие млекопитающие этим свойством не обладают.
Основное значение имеют процессы расщепления гликогена и крахмала под действием панкреатической а-амилазы.
а-амилаза имеет абсолютную потребность к ионам С1. Стабилизируется катионами Са, имеет оптимум рН~7,1.
Фермент представляет собой одноцепочный полипептид, к которому присоединен олигосахарид.
Продукты гидролиза гликогена и крахмала - это смесь олигосахаридов и конечный продукт - мальтоза.
Процесс гидролиза дисахаридов пищи происходит в дистальном отрезке двенадцатиперстной кишки и происходит он не в просвете, а в клетках слизистой оболочки. Основные ферменты:
- мальтаза
- изомальтаза
- сахараза
- лактаза.
Установлено, что изомальтаза способна гидролизовать а-1,6-гликозидфруктозидные связи, пример соединения - палатиноза; сахараза также способна гидролизовать а-1,6-
гликозидные связи. Клеточный эпителий содержит три различных фермента, имеющих (3-галактазидную активность. Ферменты: р-галаксидаза (рН~4,5), гетерогалактозидаза, истинная лактаза.
Всасывание углеводов в кишечнике.
Химическая природа моносахаридов, а также их различная структурная форма (открытая цепь, пиранозный или фуранозный цикл) имеет влияние на скорость всасывания. Галактоза > глюкоза > фруктоза > манноза > ксилоза > арабиноза.
Для последних моносахаридов всасывание носит характер облегченной диффузии; для галакто- и глюкопиранозы - это активный транспорт, при этом всасывание может идти против десятикратного градиента. Для этого процесса есть специфические переносчики. Важная роль принадлежит Na- и К- зависимым АТФ-азам.
Метаболизм глюкозы.
Концентрация глюкозы в крови человека поддерживается близкой к 5 ммоль/л. Тогда как в цитоплазме большинства клеток концентрация глюкозы очень низкая. Ее поступление в клетку осуществляется в направлении падения градиента концентрации. Это не пассивная диффузия, а облегченный процесс, природа которого мало изучена. Минимальные потребности в глюкозе имеют все ткани, но у некоторых из них, например, у клеток мозга и эритроцитов эти потребности весьма значительны.
Гликолиз (дихотомический процесс).
Это главный путь утилизации глюкоза, протекающий во всех клетках. Гликолиз - это последовательность 10 ферментативных реакций в результате которых из глюкозы образуется 2 молекулы пирувата с одновременным (субстратным) генерированием АТФ. У аэробных организмов гликолиз предшествует ОДГТВК, ЦТК и ЦПЭ. Такой гликолиз называют аэробным.
В анаэробных условиях, например, при мышечном сокращении пируват восстанавливается до лактата - это так называемый анаэробный гликолиз.
Биомедицинское значение ферментативных реакций гликолиза.
1. главный путь метаболизма глюкозы, а также фруктозы и галактозы с целью
быстрого и последующего генерирования энергии.
2. гликолиз - это путь образования строительных блоков для биосинтеза высших
жирных кислот, некоторых аминокислот и других соединений.
3. способность к образованию АТФ в анаэробных условиях, например, в интенсивно
работающих мышцах или при кислородном голодании (в сердечной мышце
возможности осуществления гликолиза ограничены, поскольку аэробные условия
просто необходимы для клеток миокарда - недостаток (^приводит к ишемии).
Известно заболевания, связанные с нарушением активности ферментов в гликолизе,
например, незначительное ингибирование пируваткиназы вызывает гемолитическую
анемию.
В быстро растущих раковых клетках активность гликолиза высока, возникает избыток
пирувата и лактата —► рН в цитоплазме повышается.
Последовательность реакций гликолиза одинакова у микробов, растений, животных и
человека.
Суммарная реакция и выход энергии при гликолизе.
Глюкоза + 2АДФ + 2 Pi + 2 НАД* à 2 пирувата + 2 АТФ + 2 НАДН + 2Н++ 2 Н2О. При субстратном фосфорилировании суммарный выход энергии гликолиза составляет 2 молекулы АТФ на 1 моль глюкозы, также в этих реакциях образуется 2 молекулы НАДН на 1 молекулу глюкозы, которые в митохондриальном матриксе в реакции
окислительного фосфорилирования потенциально могут дать 6 молекул АТФ. Реакции гликолиза протекают в цитоплазме, а окислительное фосфорилирование в митохондриях. Протоны водорода не способны проникать через мембрану митохондрий и нуждаются в специальном переносчике. Существует 2 типа челночного механизма переноса протонов водорода:
1. малатно-аспартатный, при котором потери АТФ не происходит; (8АТФ).
2. глицерофосфатный - теряется 2 молекулы АТФ (6АТФ).
Нарушения гликолиза в эритроцитах приводит к изменению транспорта О2. Гликолиз в
эритроцитах и транспорт O2 между собой.
Эритроциты характеризуются высокой концентрацией 2,3 - бифосфоглицерата =4
ммоль*л, тогда как концентрация его в других клетках низкая.
Присутствие и повышенный уровень 2,3 - БФГ в эритроцитах способствует диссоциации
Ог, из оксиНЬ и переход его в ткани.
| , |
 р
р
недостаток гексокиназы
норма
недостаток пируваткиназы
насыщение,%
Низкая концентрация 2, 3 - БФГ приводит к ненормально высокому сродству НЬ к Ov Недостаток пируваткиназы приводит к высокому уровню 2, 3 - БФГ
 2014-02-12
2014-02-12 1144
1144