Физика атомов и молекул
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (планетарную) модель атома. Согласно этой модели вокруг положительного ядра по замкнутым орбитам движутся электроны, образуя электронную оболочку атома, в области с линейными размерами порядка 10-10 м. Заряд ядра равен Zе (Z. -— порядковый номер элемента в системе Менделеева, е —. элементарный заряд), размер 10-15 – 10-14 м, масса, практически равна массе атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
Атом водорода и водородоподобные системы – это системы, состоящие из ядра с зарядом Ze и одного электрона (например, ионы He+, Li2+).
Решение задачи об энергетических уровнях электрона для атома водорода (а также водородоподобных систем: иона гелия Не+, двукратно ионизованного лития Li+ + и др.) сводится к задаче о движении электрона в кулоновском поле ядра.
Потенциальная энергия взаимодействия электрона с ядром, обладающим зарядом Zе (для атома водорода Z =1),
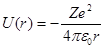 , (1)
, (1)
где r – расстояние между электроном и ядром. Графически функция U (r)изображена жирной кривой на рис. 6, неограниченно убывающей (возрастающей.по модулю) при уменьшении r, т. е. при приближении электрона к ядру.
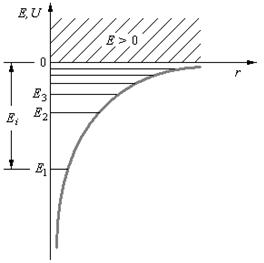
Рис. 6
Состояние электрона в атоме водорода описывается волновой функцией Ψ, удовлетворяющей стационарному уравнению Шредингера, учитывающему значение (1):'
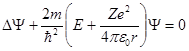 , (2)
, (2)
где m – масса электрона, Е – полная энергия электрона в атоме.
Это так называемое стационарное уравнение Шрёдингера для электрона водородоподобного атома ВДПА.
1. Энергия. В теории дифференциальных уравнений доказывается, что уравнения типа (2) имеют решения, удовлетворяющие требованиям однозначности, конечности и непрерывности волновой функции Ψ, только при собственных значениях энергии
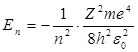 (n = 1, 2, 3,…), (3)
(n = 1, 2, 3,…), (3)
т. е. для дискретною набора отрицательных значений энергии.
Таким образом, как и в случае «потенциальной ямы» с бесконечно высокими «стенками», решение уравнения Шредингера для атома водорода приводит к появлению дискретных энергетических уровней. Возможные значения Е 1, Е 2, Е 3,... показаны па рис. 6 в виде горизонтальных прямых. Самый нижний уровень Е 1, отвечающий минимальной возможной энергии, – основной, все остальные (Еn>E1, n = 2, 3,…) – возбужденные. При Е < 0 движение электрона является связанным он находится внутри гиперболической «потенциальной ямы». Из рисунка следует, что по мере роста главного квантового числа п энергетические уровни располагаются теснее и при п=∞ Е∞= 0. При Е > 0 движение электрона является свободным; область непрерывного спектра Е >0 (заштрихована на рис. 6) соответствует ионизованному атому. Энергия ионизации атома водорода равна
Ei = - E 1 = me 4 / (8 h 2 ε 02) = 13,55 эВ.
2. Квантовые числа. В квантовой механике доказывается, что уравнению Шредингера (2) удовлетворяют собственные функции 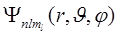 , определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным ml.
, определяемые тремя квантовыми числами: главным п, орбитальным l и магнитным ml.
Главное квантовое число n, согласно (3), определяет энергетические уровни электрона в атоме и может принимать любые целочисленные значения, начиная с единицы:
n =1, 2. 3,....
 2014-02-02
2014-02-02 8671
8671
