Система находится в равновесии, если её состояние не изменяется во времени. Подвижное динамическое равновесие сохраняется во времени не из-за отсутствия процесса, а вследствие его протекания в двух противоположных направлениях с равными скоростями. Равенство скоростей прямой и обратной реакции - условие сохранения равновесия системы.
Примером обратимой реакции является реакция
H2 + I2 2HI
2HI
Изменение скоростей прямой (v1) и обратной (v2) реакций во времени представлены на графике:
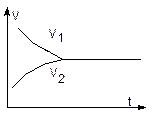
В начальный момент времени в системе имеются лишь исходные вещества H2 и I2, и отсутствует HI, поэтому v1 имеет максимальное значение, а v2 равно 0. В процессе реакции v1 уменьшается с уменьшением [H2] и [I2], а v2 увеличивается с увеличением [HI] до тех пор, пока не установится равновесие, то есть v1 станет равной v2.
Для равновесия имеем: v1 = v2 или k1´[H2]´[I2] = k2·[HI]2 или
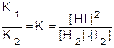 , где К - константа равновесия.
, где К - константа равновесия.
Закон действия масс: отношение произведения концентраций продуктов реакции к произведению концентраций исходных веществ, все концентрации в степенях, равных их стехиометрическим коэффициентам, есть постоянная, называемая константой равновесия.
Для mA + nB pC + qD имеем: K =
pC + qD имеем: K = 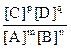
Для N2 + 3H2 2NH3 имеем: K =
2NH3 имеем: K = 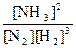
Константа равновесия - это количественная мера прямой реакции данного уравнения.
К=0 - прямая реакция не идет;
К=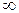 - прямая реакция идет до конца.
- прямая реакция идет до конца.
К>1 - равновесие сдвинуто вправо;
К<1 - равновесие сдвинуто влево.
Константа равновесия реакции К связана с величиной изменения стандартной энергии Гиббса DG для этой же реакции:
DG = -RTlnK или DG = -2,3RTlgK или К = 10-0,435 DG /RT
Если К>1, то lgK>0 и DG <0, то есть, если равновесие сдвинуто вправо, то реакция - переход от исходного состояния к равновесному - идет самопроизвольно.
Если К<1, то lgK<0 и DG >0, то есть, если равновесие сдвинуто влево, то реакция самопроизвольно вправо не идет.
Константа позволяет рассчитать количества веществ в момент равновесия.
Пример. В объёме, равном 1 л смешали 1 моль Н2 и 1 моль I2. Найти равновесные концентрации веществ, если К=4.
Решение. Имеем H2 + I2 2HI
2HI
Снач 1 1 0
Сравн 1-x 1-x 2x
K = 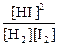 = (2x)2/(1-x)2 = 4; 2x/(1-x) = 2; 2x =2-2x, 4x=2, x=0,5. В момент равновесия имеем [H2] = [I2] = 0,5М; [HI] = 1М.
= (2x)2/(1-x)2 = 4; 2x/(1-x) = 2; 2x =2-2x, 4x=2, x=0,5. В момент равновесия имеем [H2] = [I2] = 0,5М; [HI] = 1М.
Закон смещения равновесия. Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, в системе возникает процесс, который противодействует внешнему воздействию.
Действие температуры. Увеличение температуры сдвигает равновесие в сторону эндотермической реакции. Уменьшение температуры - в сторону экзотермической реакции.
Действие давления. Повышение давления сдвигает равновесие в сторону меньшего числа газообразных молекул. Понижение давления - в сторону большего числа газообразных молекул.
Действие концентрации. Увеличение концентрации вещества сдвигает равновесие в сторону реакции, которая уменьшает количество этого вещества. Уменьшение концентрации - в сторону реакции, которая увеличивает количество этого вещества.
Пример. В какую сторону сместится равновесие
N2 + 3H2 2NH3 DН < 0
2NH3 DН < 0
а) при увеличении температуры; б) при увеличении давления; в) при увеличении концентрации водорода?
Решение: а) Поскольку DН < 0, то прямая реакция экзотермическая, а обратная эндотермическая. Согласно приведенному выше правилу, равновесие сдвигается влево.
б) Все вещества газообразные, причем в левой части уравнения четыре молекулы, а в правой - две. Равновесие сдвинется вправо.
в) Увеличение концентрации водорода сдвинет равновесие вправо.
5. Растворы.
 2014-02-02
2014-02-02 1286
1286
