Применение закона действующих масс к растворам электролитов
ББК
УДК
| ISBN | Ó Болтромеюк В.В., 2012 Ó УО «ГрГМУ», 2012 |
Электролиты и неэлектролиты. Теория
электролитической диссоциации
Все вещества делятся на 2 большие группы: электролиты и неэлектролиты.
Электролитами называются вещества (исключая металлы), растворы или расплавы которых проводят электрический ток. К электролитам относятся соединения, образованные ионными или ковалентными полярными связями. Это сложные вещества: соли, основания, кислоты, оксиды металлов (проводят электрический ток только в расплавах).
Неэлектролитами называются вещества, растворы или расплавы которых электрический ток не проводят. К ним относятся простые и сложные вещества, образованные малополярными или неполярными ковалентными связями.
Свойства растворов и расплавов электролитов впервые объяснил в конце XIX века шведский учёный Сванте Аррениус. Им была создана специальная теория электролитической диссоциации, основные положения которой, доработанные и развитые другими учёными, в настоящее время формулируются следующим образом.
1. Электролиты в растворах или расплавах распадаются на положительно и отрицательно заряженные ионы. Этот процесс называется электролитической диссоциацией. Общая сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов, поэтому растворы или расплавы электролитов в целом остаются электронейтральными. Ионы могут быть как простые, состоящие только из одного атома (Na+, Cu2+, Cl–, S2-), так и сложные, состоящие из атомов нескольких элементов (SO42–, PO43–, NH4+, [Al(OH)4]–).
Простые ионы по своим физическим, химическим и физиологическим свойствам существенно отличаются от нейтральных атомов, из которых они образовались. В первую очередь, ионы являются гораздо более устойчивыми частицами, чем нейтральные атомы, и могут существовать в растворах или расплавах неограничено долгое время, не вступая в необратимое взаимодействие с окружающей средой.
Такое различие в свойствах атомов и ионов одного и того же элемента объясняется разным электронным строением этих частиц.
Так, простые ионы s- и p-элементов находятся в более устойчивом состоянии, чем нейтральные атомы, потому что имеют завершённую электронную конфигурацию внешнего слоя, например:
| Nao | – 1ē ® | Na+ | |
| 1s22s22p6 3s1 | 1s2 2s22p6 | ||
| нейтральный атом натрия; на внешнем электронном слое находится один электрон | положительно заряженный ион натрия; на внешнем электронном слое находится 8 электронов (как у ближайшего благородного газа неона) | ||
| Fo | + 1ē ® | F– | |
| 1s2 2s22p5 | 1s2 2s22p6 | ||
| нейтральный атом фтора; на внешнем электронном слое находится 7 электронов | отрицательно заряженный ион фтора; на внешнем электронном слое находится 8 электронов | ||
Распад электролитов на ионы в расплавах осуществляется за счёт действия высоких температур, а в растворах за счёт действия молекул растворителя.
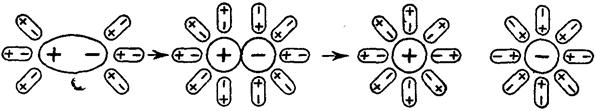
Особенностью ионных соединений является то, что в узлах их кристаллической решётки имеются уже готовые ионы, и в процессе растворения таких веществ диполям растворителя (воды) остаётся только разрушить эту ионную решётку (рис. 18).
Вещества, образованные полярными ковалентными связями, переходят в раствор в виде отдельных молекул, которые, как и молекулы Н2О, представляют собой диполи, например:

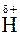 ¾
¾ 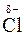 ® + –
® + –
В этом случае диполи Н2О, ориентируясь соответствующим образом вокруг растворенной молекулы электролита, вызывают в ней дальнейшую поляризацию ковалентной связи, а затем и её окончательный гетеролитический разрыв (рис. 29).
H – Cl ® H+ + Cl
 2014-02-02
2014-02-02 1794
1794







