Потенциометрия
Потенциометрией называют группу методов количественного анализа, основанных на использовании зависимости равновесного потенциала электрода, опущенного в раствор, от активности (концентрации) ионов этого раствора.
Теоретической основой потенциометрии является уравнение Нернста. Практически потенциометрия реализуется путем создания на основе исследуемой системы гальванического элемента.
В потенциометрии используют гальванические элементы, в которых потенциал одного из электродов зависит от концентрации исследуемого вещества. Этот электрод называют рабочим (индикаторным) или электродом измерения. Второй электрод в потенциометрии является электродом сравнения. Этот электрод выбирают с таким расчетом, чтобы его потенциал оставался постоянным и не зависел от состояния исследуемого раствора.
В таком случае измеренная э.д.с. будет зависеть только от потенциала индикаторного электрода. На основании изменения величины э.д.с. можно судить о концентрации вещества в исследуемом растворе.
Потенциометрические измерения являются надежными при изучении констант равновесия электродных реакций, коэффициентов активности ионов в растворе, констант нестойкости комплексных ионов, рН растворов.
Потенциометрические методы анализа имеют ряд преимуществ. Они особо чувствительны и не требуют для исследования больших объемов растворов. Существуют модификации потенциометрического определения, позволяющие проводить анализ в пробах, объем которых может не превышать десятых долей миллилитра, что важно для биологических исследований. Поскольку равновесное значение потенциала устанавливается быстро, то потенциометрические измерения не требуют значительных затрат времени. Их можно проводить в мутных и окрашенных растворах, вязких средах.
Прямая потенциометрия (ионометрия) – это потенциометрический метод, в котором индикаторным электродом является ионоселективный электрод. Ионометрия – удобный, простой, экспрессный современный метод анализа. Для его реализации достаточно подобрать соответствующий ионоселективный электрод для определяемого иона. Особенно широко ионометрия используется при определении точной концентрации ионов Н+ в растворе. В качестве индикаторного электрода, как правило, применяют стеклянный электрод, селективный по отношению к ионам Н+. Измерения э.д.с. производят с помощью специальных приборов, называемых рН-метрами. Их шкала откалибрована таким образом, что вместо измеряемой э.д.с. показывает значение рН раствора.
Потенциометрическое титрование является разновидностью титриметрических методов анализа. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке, титруют подходящим титрантом, фиксируя точку эквивалентности на основании характера изменения э.д.с. измеряемой цепи в зависимости от объема добавляемого раствора. По полученным данным строят кривую потенциометрического титрования и на этой кривой определяют точку эквивалентности и объем израсходованного титранта в точке эквивалентности.
Потенциометрическое титрование может быть использовано для определения концентрации кислоты или основания в анализируемом растворе. В этом случае составляют гальваническую цепь, содержащую индикаторный стеклянный электрод и электрод сравнения с постоянным известным потенциалом (например, хлорсеребряный):
Ag ½ AgCl, HCl ½ «смб» ½ Н3О+ ½½ KCl, AgCl ½ Ag

 a a x
a a x
индикаторный хлорсеребряный
стеклянный электрод электрод сравнения
где «смб» – стеклянная мембрана; а – известная активность ионов Н+ внутреннего раствора стеклянного электрода; ах – неизвестная активность ионов Н+ измеряемого раствора.
Э.д.с. такой гальванической цепи будет зависеть от концентрации ионов Н+ в исследуемом растворе. Измеряя её с помощью соответствующего прибора, можно непосредственно определить рН среды.
Титруемый раствор строго определенного объема помещают в электролитическую ячейку с электродами и при перемешивании из бюретки небольшими порциями добавляют титрант (например, раствор щелочи при определении концентрации кислоты в исследуемой системе). После каждого добавления очередной порции раствора щелочи с помощью потенциометра определяют рН раствора и затем по полученным данным строят кривую титрования в координатах рН раствора – V (титранта) (рис. 104).
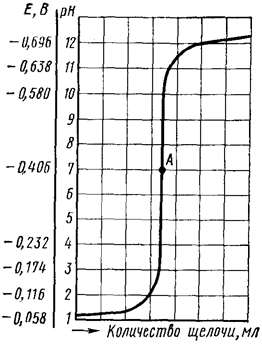
Рис. 104. Кривая потенциометрического титрования соляной кислоты гидроксидом натрия: А – точка эквивалентности
В случае титрования сильной кислоты щелочью точка эквивалентности будет лежать на середине скачка титрования (рН = 7).
В ряде случаев чувствительность потенциометрического метода превышает чувствительность обычного объемного метода, а также метода кондуктометрического титрования.
 2014-02-02
2014-02-02 9891
9891
