Изотермический процесс – процесс, протекающий при постоянной температуре T (T = const). Из уравнения (7.18) состояния идеального газа следует, что при постоянной температуре T и неизменном количестве вещества ν в сосуде произведение давления p газа на его объем V должно оставаться постоянным:
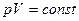 или
или 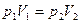 . (7.21)
. (7.21)
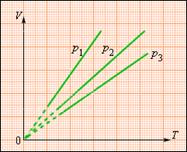 |
| Рис7.3. Семейство изобар. p3 > p2 > p1 |
На диаграмме (p, V) изотермические процессы изображаются при различных значениях температуры T семейством гипербол p ~ 1 / V, которые называются изотермами. Изотермы, соответствующие более высоким значениям температуры, располагаются на графике выше изотерм, соответствующих меньшим значениям температуры (рис. 7.1). Уравнение (7.20) изотермического процесса было получено из эксперимента английским физиком Р. Бойлем (1662 г.) и независимо французским физиком Э. Мариоттом (1676 г.). Поэтому это уравнение называют законом Бойля–Мариотта.
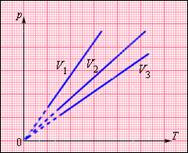 |
| Рис.7.2. Семейство изохор. V3 > V2 > V1 |
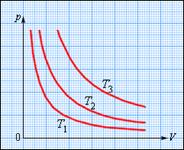 |
| Рис.7.1. Семейство изотерм. T3 > T2 > T1 |
Изохорный процесс – это процесс нагревания или охлаждения газа при постоянном объеме V (V = const) и при условии, что количество вещества ν в сосуде остается неизменным.
Из уравнения (7.18) состояния идеального газа следует, что при этих условиях давление газа p изменяется прямо пропорционально его абсолютной температуре:
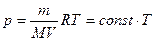 или
или 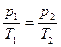 . (7.22)
. (7.22)
На диаграмме (p, T) изохорные процессы для заданного количества вещества ν при различных значениях объема V изображаются семейством прямых линий, которые называются изохорами. Большим значениям объема соответствуют изохоры с меньшим наклоном по отношению к оси температур (рис. 7.2).
Экспериментально зависимость давления газа от температуры исследовал французский физик Ж. Шарль (1787 г.). Поэтому уравнение (7.21) изохорного процесса называется законом Шарля.
Уравнение изохорного процесса может быть записано в виде:
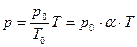 , (7.23)
, (7.23)
где p0 – давление газа при T = T0 = 273,15 К (т. е. при температуре 0 °С). Коэффициент α, равный (1/273,15) К–1, называют температурным коэффициентом дав ления.
Изобарный процесс – процесс, протекающий при неизменным давлении p (p = const).
Уравнение изобарного процесса для некоторого неизменного количества вещества ν имеет вид:
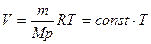 или
или 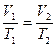 , (7.24)
, (7.24)
На диаграмме (V, T) изобарные процессы при разных значениях давления p изображаются семейством прямых линий (рис. 7.3), которые называются изобарами.
Зависимость объема газа от температуры при неизменном давлении была экспериментально исследована французским физиком Ж.Гей-Люссаком (1862 г.). Поэтому уравнение изобарного процесса называют законом Гей-Люссака.
Уравнение изобарного процесса может быть записано в виде:
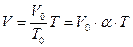 , (7.25)
, (7.25)
где V0 – объем газа при температуре 0 °С. Коэффициент α равен (1/273,15) К–1. Его называют температурным коэффициентом объемного расширения газов.
Уравнения (7.21), (7.22) и (7.24) легко получаются из уравнения (7.20) объединенного газового закона.
 2014-02-02
2014-02-02 3585
3585








