Простейшей моделью, рассматриваемой молекулярно-кинетической теорией, является модель идеального газа. В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений. Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ. Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур. Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, объем, температура).
В модели идеального газа предполагается, что все столкновения молекул друг с другом и со стенками сосуда происходят по законам упругого удара, т. е. подчиняются законам механики Ньютона. При столкновениях молекул газа со стенкой сосуда возникает сила давления газа на стенку. Отношение силы давления к площади поверхности определяет давление p газа на стенку сосуда или на любую поверхность, находящуюся в газе:
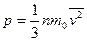 , (7.5)
, (7.5)
где 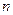 - концентрация молекул газа;
- концентрация молекул газа; 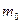 - масса молекулы газа;
- масса молекулы газа; 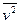 - среднее значение квадрата скорости молекул газа. Это уравнение называется основным уравнением молекулярно-кинетической теории. Молекулы газа имеют различные скорости, поэтому значения квадрата скорости тоже будут различными. Среднее значение квадрата скорости молекул газа определяется формулой:
- среднее значение квадрата скорости молекул газа. Это уравнение называется основным уравнением молекулярно-кинетической теории. Молекулы газа имеют различные скорости, поэтому значения квадрата скорости тоже будут различными. Среднее значение квадрата скорости молекул газа определяется формулой:
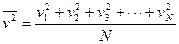 , (7.6)
, (7.6)
где N – число молекул в газе.
Средняя кинетическая энергия поступательного движения молекул газа определяется по формуле:
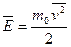 . (7.8)
. (7.8)
Теперь уравнение (7.5)можно записать в виде:
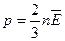 . (7.9)
. (7.9)
Мы получили важный результат: давление идеального газа пропорционально концентрации молекул и средней кинетической энергии поступательного движения молекул.
Далее необходимо выяснить, отчего зависитсредняя кинетическая энергия поступательного движения молекул газа.
 2014-02-02
2014-02-02 1957
1957
