Производство кислот
Серная кислота является одним из важнейших продуктов, характеризующий общий уровень развития химической промышленности страны. Объем производства серной кислоты исчисляется десятками миллионов тонн и среди продуктов химической промышленности она по праву занимает первое место. Это объясняется ее широким использованием в различных отраслях промышленности. Серная кислота одна из самых сильных минеральных кислот и самая дешевая. Самый крупный ее потребитель – производство минеральных удобрений (≈41% вырабатываемой в России кислоты): она необходима для получения двойного суперфосфата, фосфорной кислоты и сульфата аммония.
Другие области применения серной кислоты: нефтепереработка, производство синтетических волокон, металлургия, производство красителей и пигментов, текстильная и кожевенная промышленности, гальваника, производство взрывчатых веществ и т.д.
Исходным веществом для производства серной кислоты является сернистый ангидрид SO2, который образуется в результате сжигания серы или серосодержащего сырья. Переработка сернистого ангидрида в серную кислоту включает обязательное его окисление до серного ангидрида и последующую адсорбцию его водой.
|
|
|
S+O2→SO2
SO2+1/2O2+H2O→H2SO4
Скорость взаимодействия сернистого ангидрида с кислородом в обычных условиях очень мала, поэтому в промышленности эту реакцию проводят:
1. Контактным методом – это окисление SO2 кислородом на катализаторе
2. Нитрозным методом окисления с помощью оксидов азота, содержащихся в серной кислоте.
В настоящее время контактным методом получают более 80% всего объема серной кислоты и олеума.
Серную кислоту получают уже более 1000 лет.
Первое упоминание о серной кислоте обнаружено в сочинениях персидского алхимика в 940 году.
В 13 веке серную кислоту получали алхимики из «зеленого камня» (железный купорос) или квасцов путем сильного нагревания (прокаливания). Так, например, из железного купороса получали тяжелую маслянистую жидкость – купоросное масло:
2(FeSO4´7Н2O) = Fe2O3 + Н2SO4 + SO2 + 13Н2O.
Первое упоминание о кислых газах, получаемых при прокаливании квасцов или купороса, встречается в сочинениях, приписываемых арабскому алхимику Джафар аль-Суфи (Гебер), жившему в VIII в. Некоторые ученые приписывают честь открытия серной кислоты персидскому алхимику Абубекеру аль-Рази, жившему в Х в. Более определенно говорит о серной кислоте алхимик Альберт Великий.
В 15 веке серную кислоту получали совместным сжиганием серы и селитры в сосудах большого объема, стенки которого смачивали водой. Этим способом ее и получали более 300 лет, но небольшими количествами в ретортах – стеклянных колбах.
|
|
|
Таким способом получали кислоту на первом промышленном заводе в Англии. Сжигали в металлических сосудах, а выделяющиеся газы поглощали водой в другом аппарате – стеклянном.
И только в середине XVIII в. (в 1746гю), когда обнаружили, что свинец является материалом весьма стойким против серной кислоты, стали постепенно переходить от стеклянной лабораторной аппаратуры к большим свинцовым коробкам или камерам, отчего пошло название – камерный способ.. В них сжигалась смесь серы и селитры. Образовавшийся оксид серы(VI) SO3 здесь же поглощался водой или раствором кислоты, налитой в камеры. Процесс приходилось прерывать для загрузки камер.
Контактный метод возник в 1831г. когда англичанин Филипс предложил окислять SO2 кислородом, пропуская через раскаленный платиновый катализатор.
Промышленное производство серной кислоты получило быстрое развитие в начале XIX в. Этот рост был вызван развитием производства соды и других продуктов, для которых была необходима серная кислота. В это время химики Н. Клеман и Ш. Б. Дезорм выяснили сущность процесса. Они показали, что оксиды азота играют роль передатчиков кислорода воздуха диоксиду серы, и предложили питать камеры непрерывным током сернистого газа SO2, для чего стали сжигать серу в отдельных печах. Вместо селитры употребляли азотную кислоту. Кроме того, в камеры вводили водяной пар. Производство стало непрерывным, однако кислота обходилась дорого до тех пор, пока единственным сырьем для него была сера, а расход азотной кислоты был велик, т.к. оксиды азота безвозвратно терялись с отходящими газами.
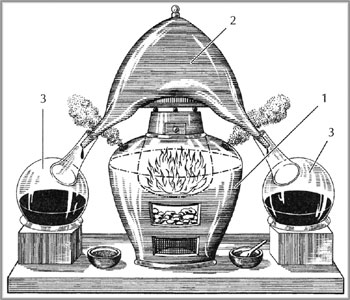
Рис. 1 Установка для получения серной кислоты сжиганием серы в присутствии селитры, XVIII в.: 1 – печь, разогреваемая углями; 2 – стеклянный сосуд, где образующиеся газы взаимодействуют с парами воды; 3 – колбы, в которые собирают олеум
Дальнейшие работы химиков устранили эти недостатки. Ж.Л.Гей-Люссак предложил улавливать оксиды азота при помощи серной кислоты, стекающей в установленную после камер башню навстречу отходящим газам.
Получающуюся в башнях кислоту называют нитрозой. Английский технолог Дж. Гловер предложил выделять оксиды азота из нитрозы в башне, в которой навстречу кислоте проходят газы обжига. Эту башню ставят перед камерами. Оксиды азота поступают в камеры, и таким образом совершается их круговорот. Таким образом, осуществлялся нитрозный способ (оксиды азота выделялись за счет разложения селитры).
Еще в XV–XVI вв. извлекать серу умели из пирита FeS2 – более дешевого и распространенного сырья, чем сера. В 1833 г. было предложено использовать этот минерал для получения из него сернистого газа и построить для этой цели специальную печь.
Благодаря всем этим усовершенствованиям серная кислота стала дешевым продуктом.
 2014-02-02
2014-02-02 11869
11869
