I. Целевым продуктом являются аренсульфоновые кислоты, которые называют, добавляя к названию основы окончание «сульфокислота» («сульфоновая кислота»).
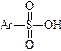
Сульфокислоты, как правило, являются твердыми гигроскопичными кристаллическими веществами, хорошо растворимыми в воде. Это сильные кислоты, по силе близки к минеральным. В разбавленных водных растворах они диссоциируют практически нацело.
II. Сульфирующие агенты: строение, свойства и область применения
А)Безводная серная кислота при комнатной температуре представляет собой тяжелую маслянистую жидкость, т.к. её молекулы за счет водородных связей образуют полимер, который при повышении температуры разрушается:
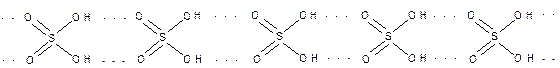
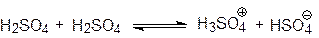
Кипит она ~ при 300оС с разложением, образуя азеотропную смесь состава 98,3% H2SO4 и 1,7% Н2О. Жидкая 100%-ая серная кислота является ионизирующимрастворителем, однако, ее собственная ионизация незначительная:
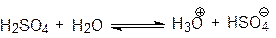
Серная кислота смешиваетсяс Н2О и SO3 в любых соотношениях. В водных растворах она полностью диссоциирована:
Для промышленного сульфирования чаще всего используют купоросное масло (92-93%-ную H2SO4) и 98-100%-ную серную кислоту. Концентрированная H2SO4 является довольно сильным окислителем, особенно при нагревании.
Б)Олеум образуетсяпри растворении SO3 в концентрированной серной кислоте и представляет собой смесь кислот: H2SO4 (серной), H2S2O7 (двусерной), H2S3O10 (трисерной) и др., а также SO3:
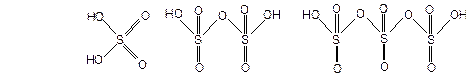
При концентрации сульфотриоксида 20 – 25% и 60 – 65% олеум представляет собой густую маслянистую, дымящуюся на воздухе жидкость. При других концентрациях SO3, олеум при комнатной температуре является твердым веществом.
В)Серный ангидрид – это общее название нескольких модификаций триоксида серы. Молекула SO3 существует в виде мономерной, тримерной и полимерной форм:
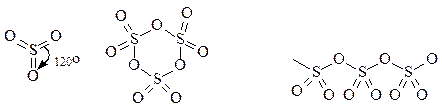
SO3 мономер (SO3)3 тример (SO3)n полимер
В газовой фазе и в разбавленных неводных растворах триоксид серы находится в мономерной форме. При конденсации паров SO3 образуется летучая бесцветная жидкость (tк=44,8оС), состоящая преимущественно из циклических тримерных молекул (SO3)3. При охлаждении до 16,8оС она затвердевает с образованием прозрачных кристаллов. Эта форма SO3 неустойчива и при хранении превращается в устойчивые, похожие на асбест нити. Полимеризацию SO3 предотвращают введением Р2О5 и других ингибиторов.
Для сульфирования серный ангидрид получают: а) обжигом пирита и последующим каталитическим окислением SO2 в SO3; б) из баллонов под давлением в жидком стабилизированном виде, поступающих на предприятия со специализированных заводов; в) десорбцией из высокопроцентного олеума при нагревании. Остающаяся после десорбции серного ангидрида 100%-ная серная кислота может быть использована в других производствах. Первый метод применяют на производствах большой мощности, например, заводы по синтезу поверхностно-активных веществ (ПАВ) сульфированием (сульфатированием) первичных спиртов, олефинов, алкилбензолов и т.п. Остальные - на предприятиях с малой мощностью, например, на ХФЗ.
 2014-02-18
2014-02-18 2640
2640








