Золото и его сплавы
Лекция № 3
Золото – химический элемент, металл. Атомный номер 79, атомный вес 196,97 г/см3. Кристаллическая решетка – кубическая гранецентрированная ГЦК. Температура плавления 1063 ºС, кипения 2970 ºС. Твердость по Бринеллю – 18,5.
Золото – метал желтого цвета. Золото – благородный металл, оно не взаимодействует с кислотами (кроме смеси соляной и азотной кислот – «царской водки»), устойчиво в атмосфере, воде пресной и морской,
Золото имеет высокую отражательную способность, хорошо полируется и обладает высокой пластичностью – прокатывается _в листы толщиной до 0,0001 мм. Тепло- и электропроводность у золота ниже чем у меди. В ювелирном деле из-за высокой прочности твердости золото используется в виде сплавов с другими металлами и очень редко в чистом виде.
И ювелирном деле чистое золото применяется редко, в основном как сусальное для золочения. Применяется сплавы золото с медью, серебром, платиной, палладием и пр. Применение сплавов золота обусловлена тем, что чистое золото слишком мягкое, мало прочное, имеет не слишком привлекательный красный цвет.
| Марка | Химический состав, % (по массе) | |||||||
| Золото, не менее | Примеси, не более | |||||||
| Pb | Fe | Sb | Vi | Cu | Ag | Всего | ||
| Зл 999,9 | 99,99 | 0,003 | 0,004 | 0,001 | 0,002 | 0,007 | 0,008 | 0,01 |
| Зл 999 | 99,90 | 0,003 | 0,035 | 0,002 | 0,002 | 0,012 | 0,020 | 0,10 |
Среди двухкомпонентных сплавов золота иногда встречаются в ювелирной промышленности сплавы золота – медь и золото – серебро.
Золото и медь обладают неограниченной растворимостью в жидком, а при высоких температурах и в твердом состоянии (образуют непрерывный ряд твердых растворов). Кривые плавкости начинаются от точки плавления меди (1083 ºС). Точка ликвидуса и солидуса находятся ниже точек плавления чистых металлов и достигают минимума (910 ºС) при массовом соотношении компонентов 80% Au и 20% Cu.
Диаграмма состояния золото-медь приведена на рисунке
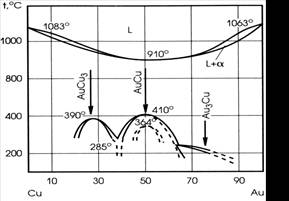
Ниже линии солидуса в системе Au – Cu происходит упорядочение при образовании всех этих соединений, как и во всех фазовых превращениях, происходит путем зарождения и роста выпавшей из твердого раствора фазы. Температурные условия и характер реакций, приводящих к образованию этих соединений, рассмотрены ниже.
Между областями существования AuCu и 3AuCu распад твердого раствора протекает по перитектоидной реакции при температуре 230 – 240 С: AuCu + твердый раствор = 3AuCu. Критическая температура дла сплава стехиометрического состава определена равной 190 – 200 С. При содержании в сплаве менее 25% Cu следы упорядочения отсутствуют даже после месячной выдержки при 160 С.
Соединение AuCu. Превращение «тверый раствор = AuCu» состоит в упорядочении расположения атомов в решетке при одновременном изменении типа существующей ГЦК-решетка. Установлена, что соединение AuCu существует в двух модификациях: (AuCu)I и (AuCu)II, имеющих соответственно упорядоченные тетрагональную и орторомбическую структуры. В сплавах с атомной долей меди от 38 до 60% имеют место следующие превращения в твердом состоянии: «неупорядоченный твердый раствор = (AuCu)II = (AuCu)I».
Фаза(AuCu)I имеет тетрагональную решетку с с/а = 0,92. Упорядочение представляется как переподготовку атомов меди и золота таким образам, что плоскости 002 оказываются чередующимися плоскостями из атомов меди и золота.
Кристаллографическая элементарная ячейка фазы (AuCu)II состоит из десяти тетрагональных ячеек (AuCu)I. Температура превращения «неупорядоченный твердый раствор = (AuCu)II» лежит в пределах 367 – 430 С. Наиболее достоверной для этого превращения является температура 410 С.
Соединение AuCu3. Превращение «твердый раствор = AuCu3» состоит в упорядочении атомов в ГЦК-решетке. Температура превращения, по данным большинства исследователей, находится в интервале 380 – 390 С.
Было установлено, что в сплавах, близких по составу к AuCu3, при содержании золота, превышающем стехиометрическое, в некотором интервале составов наблюдаются три структурные формы: α, AuCu3)II→ (AuCu3)I, причем области существования фаз ((AuCu3)I, (AuCu3)I+(AuCu3)II) и ((AuCu3)II+α) взаимно перекрываются.
Фаза (AuCu3)I имеет кубическую структуру (типа AuCu3), фаза (AuCu3)II имеет упорядоченную антифазную доменную структуру.
Область (AuCu+AuCu3). В системе Au – Cu имеет место эвтектоидная реакция распада неупорядоченного α-твердого раствора золота и меди на смесь (AuCu+AuCu3). Температура эвтектоидной реакции 284˚, граница двухфазной области (AuCu+AuCu3) расположены при 60 - 65% Cu.
Химический состав золото-медных сплавов приведен в таблице
| Марка | Химический состав | ||||||
| Золото | Медь | Примеси, не более | |||||
| Pb | Fe | Sb | Vi | Сумма нормируемых примесей | |||
| ЗлМ980 | 97,3-98,3 | 1,7-2,7 | 0,005 | 0,10 | 0,005 | 0,005 | 0,11 |
| ЗлМ916 | 91,3-91,9 | 8,1-8,7 | 0,005 | 0,10 | 0,005 | 0,005 | 0,16 |
| ЗлМ900 | 89,7-90,3 | 9,7-10,3 | 0,005 | 0,10 | 0,005 | 0,005 | 0,16 |
| ЗлМ583 | 58,0-58,6 | 41,-442 | 0,005 | 0,10 | 0,005 | 0,005 | 0,16 |
В сплавах золото-медь буквами указывается основной и легирующей элемент, а цифрами – лишь содержание золото (проба). Например, марка двухкомпонентного сплава ЗлМ583, означает, что сплав содержит 58,3% золота, остальное – медь.
В системе Au – Ag образуется непрерывный ряд твердых растворов
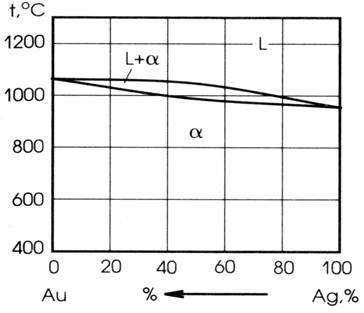
Кривые ликвидуса и солидуса в этой системе близки, и интервал кристаллизации сплавов в средней части диаграммы не превышает 2˚С. Цвет сплавов меняется с повышением содержания серебра от красного, соответствующему чистому золоту, до белого цвета – чистого серебра. Сплавы с содержанием золото в пределах от 60 до 70% имеет красивый зеленый оттенок, однако из-за низких механических свойств применяется редко. Сплавы Au – Ag обладают хорошими литейными способностями, пластичны, имеют высокую коррозионную стойкость, однако мало применяется в технике из-за низкой твердости.
Из-за небогатой цветовой гаммы и малой стойкости к истиранию сплавы этой системы не находят применения в ювелирном деле, а используются для изготовления контактов, проводников и других деталей в электротехнике.
 2014-02-02
2014-02-02 2879
2879
