Во внутренней сфере между комплексообразователем и лигандами существуют ковалентные связи, образованные, в том числе, и по донорно-акцепторному механизму. Для образования таких связей необходимо наличие свободных орбиталей у одних частиц (имеются у комплексообразователя) и неподеленных электронных пар у других частиц (лиганды). Роль донора (поставщика электронов) играет лиганд, а акцептором, принимающим электроны, является комплексообразователь. Донорно-акцепторная связь возникает как результат перекрывания свободных валентных орбиталей комплексообразователя с заполненными орбиталями донора.
Между внешней и внутренней сферой существует ионная связь. Приведем пример.
Электронное строение атома бериллия:
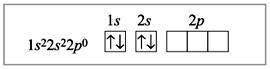
Электронное строение атома бериллия в возбужденном состоянии:
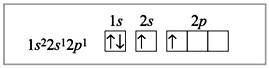
Электронное строение атома бериллия в комплексном ионе [BeF4]2–:
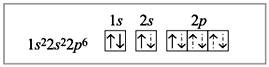
Пунктирными стрелками показаны электроны фтора; две связи из четырех образованы по донорно-акцепторному механизму. В данном случае атом Be является акцептором, а ионы фтора – донорами, их свободные электронные пары заполняют гибридизованные орбитали (sp3-гибридизация).
Номенклатура комплексных соединений. В соединении сначала называют анион, а затем катион. При указании состава внутренней сферы прежде всего называют анионы, прибавляя к латинскому названию суффикс -о-, например: Cl– – хлоро, CN– – циано, OH– – гидроксо и т.д. Далее называют нейтральные лиганды и, в первую очередь, аммиак и его производные. При этом пользуются терминами: для координированного аммиака – аммин, для воды – аква. Число лигандов указывают греческими словами: 1 – моно, 2 – ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса. Затем переходят к названию центрального атома. Если центральный атом входит в состав катионов, то используют русское название соответствующего элемента и в скобках указывают его степень окисления (римскими цифрами). Если центральный атом содержится в анионе, то употребляют латинское название элемента, а в конце прибавляют окончание - ат. В случае неэлектролитов степень окисления центрального атома не приводят, т.к. она однозначно определяется из условия электронейтральности комплекса.
Примеры. Чтобы назвать комплекс [Cu(NH3)4]Сl2, определяют степень окисления (С.О.) х комплексообразователя – иона Cuх+:
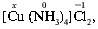
1•x + 2•(–1) = 0, x = +2, C.O.(Cu) = +2.
Аналогично находят степень окисления иона кобальта:
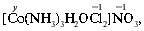
y + 2•(–1) + (–1) = 0, y = +3, С.О.(Со) = +3.
Чему равно координационное число кобальта в этом соединении? Сколько молекул и ионов окружает центральный ион? Координационное число кобальта равно шести.
Название комплексного иона пишут в одно слово. Степень окисления центрального атома обозначают римской цифрой, помещенной в круглые скобки. Например:
[Cu(NH3)4]Cl2 – хлорид тетраамминмеди(II),
[Co(NH3)3H2OCl2]NO3 – нитрат дихлороакватриамминкобальта(III),
K3[Fe(CN)6] – гексацианоферрат(III) калия,
K2[PtCl4] – тетрахлороплатинат(II) калия,
[Zn(NH3)4Cl2] – дихлоротетраамминцинк,
H2[SnCl6] – гексахлорооловянная кислота.
На примере нескольких комплексных соединений определим структуру молекул (ион-комплексообразователь, его С.О., координационное число, лиганды, внутреннюю и внешнюю сферы), дадим название комплексу, запишем уравнения электролитической диссоциации.
K4[Fe(CN)6] – гексацианоферрат(II) калия,
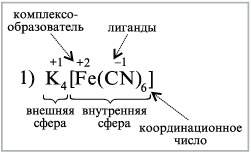
K4[Fe(CN)6] 4K+ + [Fe(CN)6]4–.
H[AuCl4] – тетрахлорозолотая кислота (образуется при растворении золота в «царской водке»),
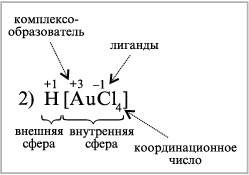
H[AuCl4] H+ + [AuCl4]–.
[Ag(NH3)2]OH – гидроксид диамминсеребра(I) (это вещество участвует в реакции «серебряного зеркала»),
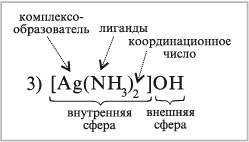
[Ag(NH3)2]OH [Ag(NH3)2]+ + OH–.
Na[Al(OH)4] – тетрагидроксоалюминат натрия,
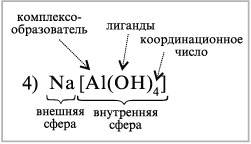
Na[Al(OH)4] Na+ + [Al(OH)4]–.
К комплексным соединениям относятся и многие органические вещества, в частности, известные вам продукты взаимодействия аминов с водой и кислотами. Например, соли хлорид метиламмония и хлорид фениламмония являются комплексными соединениями. Согласно координационной теории они имеют следующее строение:
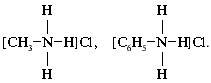
Здесь атом азота – комплексообразователь, атомы водорода при азоте, радикалы метил и фенил – лиганды. Вместе они образуют внутреннюю сферу. Во внешней сфере находятся хлорид-ионы.
Многие органические вещества, имеющие большое значение в жизнедеятельности организмов, представляют собой комплексные соединения. К ним относятся гемоглобин, хлорофилл, ферменты и др.
 2014-02-02
2014-02-02 5949
5949
