Основное уравнение молекулярно-кинетической теории связывает параметры состояния газа с характеристиками движения его молекул, т. е. устанавливает зависимость между давлением и объемом газа и кинетической энергией поступательного движения его молекул.
Для вывода уравнения рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически с одной и той же скоростью v, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку DS (рис. 1) и вычислим давление, оказываемое на эту площадку. При каждом соударении молекула массой т0 передает стенке сосуда импульс mov - (- mov) = 2 mov.
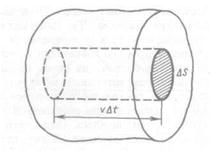
Рис.1.
За время Dt площадки DS достигнут только те молекулы, которые заключены в объеме цилиндра с основанием DS и высотой v Dt. Число этих молекул равно п DS v Dt (n — число молекул в единице объема). Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент 'времени вдоль каждого из них движется 1/3 молекул, причем половина молекул движется вдоль данного направления в одну сторону, половина — в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку DS будет 1/6 п DS vDt.. При столкновении с площадкой эти молекулы передадут ей импульс P=2 mov 1/6 п DS vDt = 1/3 п mov 2 DSDt
Тогда давление газа, оказываемое им на стенку сосуда,
р = F/DS=P/(DSDt)=1/3 п mov 2 (1),
(так как F=dP/dt).
Если газ в объеме V содержит N молекул, движущихся с разными скоростями, то можно рассматривать среднюю квадратичную скорость, характеризующую всю совокупность молекул газа.
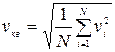 (2)
(2)
Уравнение (1) с учетом (2) примет вид
р = 1/3 п mov кв2 (3)
Учитывая, что п = N/V, получим рV = 1/3 N mov кв2
или рV = 2/3 N (mov кв2/2)= 2/3 E (4),
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Выражение (4) (т.е. рV = 2/3 E) или эквивалентное ему (3) называется основным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Учитывая, что с одной стороны p = n kT, а с другой р = 1/3 п mov кв2, получим выражение для средней квадратичной скорости
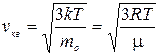 (5),
(5),
так как молярная масса m = m0NA, где т0 — масса одной молекулы, NA — постоянная Авогадро, к = R/NA. Отсюда легко найти, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа, используя, что p = n kT, и р = 1/3 п mov кв2, равна
e = movкв 2/2 =3/2kT
Т.е. она пропорциональна термодинамической температуре и зависит только от нее. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа.
При выводе основного уравнения молекулярно-кинетической теории газов и максвелловского распределения молекул по скоростям предполагалось, что на молекулы газа внешние силы не действуют, поэтому молекулы равномерно распределены по объему. Однако молекулы любого газа находятся в потенциальном поле тяготения Земли. Тяготение, с одной стороны, и тепловое движение молекул — с другой, приводят к некоторому стационарному состоянию газа, при котором давление газа с высотой убывает.
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова. Если атмосферное давление на высоте h равно р, то на высоте h + dh оно равно р + dp (при dh > О dp < 0, так как давление с высотой убывает). Разность давлений р и р + dp равна весу газа, заключенного в объеме цилиндра высотой dh с основанием площадью, равной единице площади:
р - (р + dp) = ρ gdh,
где ρ — плотность газа на высоте h. Следовательно,
dp =- ρ gdh. (1)
Воспользовавшись уравнением состояния идеального газа pV = m/mRT,где m -масса газа, m — молярная масса газа), находим, что плотность газа равна
r= m/V = pm/(RT).
Подставив в (1), получим
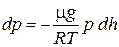 или
или 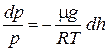
Проинтегрируем это уравнение с учетом того, что р — давление на высоте h, а давление на h =0 (на поверхности земли) равно po.

Получим
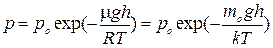 (2),
(2),
так как m = m0NA, и R = kNA, где тo — масса одной молекулы, NA — постоянная Авогадро.
Выражение (2) называется барометрической формулой. Она позволяет найти атмосферное давление в зависимости от высоты (или, измерив давление, найти высоту). Из этой формулы следует, что давление с высотой убывает тем быстрее, чем тяжелее газ.
Барометрическую формулу (2) можно преобразовать, если воспользоваться выражением р = пкТ:
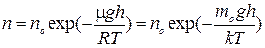 (3)
(3)
Здесь n — концентрация частиц на высоте h, а no - концентрация частиц на высоте h =0.
Из формулы (3) следует, что с понижением температуры число молекул на определенной высоте h убывает. При T =0 все молекулы оказались бы на поверхности земли. Сила тяжести стремиться опустить молекулу на землю, а тепловое движение разбрасывает их по высотам, поэтому распределение молекул в атмосфере с высотой определяется балансом этих тенденций.
Если учесть, что mogh = П — потенциальная энергия молекулы в поле тяготения то формулу можно переписать.
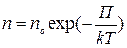 (4)
(4)
Выражение (4) называется распределением Больцмана во внешнем потенциальном поле. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул.
Если частицы имеют одинаковую массу и находятся в состоянии хаотического теплового движения, то распределение Больцмана (4) справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
35. Средняя энергия молекул. Число степеней свободы газовых молекул и теплоемкость газов. Закон равнораспределения энергии по степеням свободы. Трудности классической теории теплоемкости газов.
 2014-02-02
2014-02-02 8595
8595
