Газ, потенциальной энергией взаимодействия между молекулами которого нельзя пренебречь, называется реальным.
Уравнение состояния идеального газа (уравнение Клапейрона – Менделеева) для одного моля имеет вид
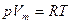 .
.
Для реального газа Ван дер Вальс дополнил это уравнение поправками, учитывающими собственный объем молекул (b) и силы межмолекулярного взаимодействия (притяжения), создающие дополнительное давление на газ (p’ = a/Vm 2).
Уравнение Ван дер Ваальса (уравнение состояния реального газа) для одного моля реального газа
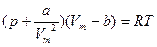 .
.
a, b – постоянные Ван дер Вальса (b - суммарный объем всех молекул газа).
Для n молей газа, занимающих объем V, учитывая что Vm = V / n, у равнение Ван дер Вальса имеет вид
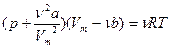
Внутренняя энергия одного моля реального газа Um складывается из кинетической энергии движения частиц (Um’ = CVT, такой же как и идеального газа) и потенциальной энергии взаимодействия молекул газа (Um’’ =ò p’dVm ò a/Vm 2 dVm = -a/Vm).
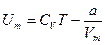 для одного моля газа,
для одного моля газа,
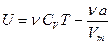 для n молей газа.
для n молей газа.
33. Давление газа на стенку. Основное уравнение молекулярно- кинетической теории идеальных газов
 2014-02-02
2014-02-02 2144
2144
