Обрыв цепей
Цепная ракция перекисного окисления липидов
Рис.2.
В конце концов цепи обрываются, поскольку свободные радикалы L·и LO2·, "ведущие" цепи окисления, исчезают из-за одной из возможных реакций обрыва цепей. Это могут быть следующие реакции:
L· + L· -> LL (4)
L· + LO2· -> LOOL (5)
LO2· + LO2· -> L=O + LOH + фотон (6)
Последняя реакция диспропорционирования радикалов LO2· интересна тем, что она сопровождается свечением - хемилюминесценцией. В липид-содержащих системах длина цепей может составлять десятки и сотни звеньев. Для организма цепное окисление липидов - весьма нежелательное явление не только потому, что оно приводит к бесполезному сжиганию ценных компонентов клетки, но ещё и потому, что некоторые продукты цепного окисления липидов чрезвычайно токсичны. В связи с этим имеется целая система защиты от перекисного окисления, в частности, имеются вещества, "перехватчики" свободных радикалов, которые тормозят цепное окисление за счёт ещё одной реакции обрыва цепей:
L· + InH -> LH + In· (7)
где In· - свободный радикал ингибитора цепного окисления. К числу молекул - перехватчиков радикалов относятся токоферол (витамин Е), женские половые (стероидные) гормоны, коэнзим Q (убихинон), многие другие соединения. Хотя в реакции 7 образуются радикалы этих соединений, эти радикалы недостаточно активны, чтобы оторвать атом водорода от молекул жирных кислот, и поэтому не инициируют новых цепей окисления. Обычно они быстро исчезают, например, вследствие взаимодействия друг с другом:
In· + In· -> In-In (8)
Все соединения, тормозящие процессы цепного окисления липидов, называются антиоксидантами. К числу антиоксидантов относятся и перехватчики свободных радикалов. Антиоксидантными свойствами в определённых условиях обладают ионы металлов переменной валентности в восстановленной форме, в частности, ионы Fe2+. Они также способны перехватывать свободные радикалы в одной из следующих реакций:
Fe2+ + L· + H+ -> Fe3+ + LH (9)
Fe2+ + LO2· + H+ -> Fe3+ + LOOH (9а)
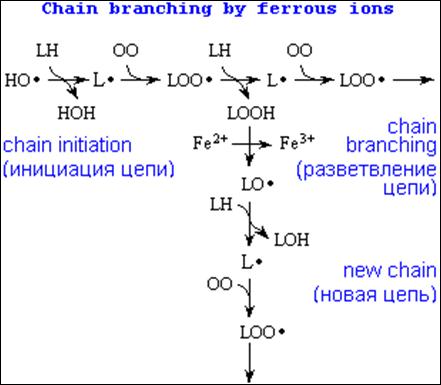
В большинстве случаев ионы Fe2+ обладают однако не анти-, а прооксидантным действием, т.е. они не подавляют, а наоборот, резко усиливают процессы перекисного окисления. Это происходит потому, что ионы двухвалентного железа вступают в реакцию с продуктом перекисного окисления - гидроперекисями липидов:
Fe2+ + LOOH -> Fe3+ + LO· + OH- (10)
В результате появляется новый свободный радикал (алкоксильный радикал липида) LO·, который инициирует образование новой цепи окисления:
LO· + LH -> LOH + L· (11)
L· + O2 -> LO2· (2)
LO2· + LH -> LOOH + L· (3)
и далее реакции 2-3, 2-3, 2-3 и т.д. Разветвление цепей более наглядно видно на рис.3. Разветвление цепи перекисного окисления липидов ионами железа
 2014-02-03
2014-02-03 523
523








