Задачей термодинамической теории смесей газов является вычисление свойств и параметров смеси по заданным свойствам и параметрам компонентов смеси и её составу. Рассматриваются равновесные смеси идеальных не реагирующих газов, состав которых не изменяется в процессах смешения и изменения их термодинамического состояния.
Пусть в объёме V находится смесь n химически различных идеальных газов при давлении p и температуре T. Для каждого из компонентов известны их массы Mi, химические формулы, молярные массы μi, (i = 1,2,3,…, n). Так как каждый из компонентов смеси является идеальным газом и ведёт себя независимо от присутствия других газов, то для них можно записать термическое уравнение состояния:
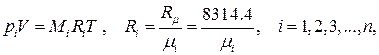 (1.23)
(1.23)
где учтено, что каждый из компонентов смеси занимает весь её объём.
Величина pi носит название парциального давления i –го компонента в смеси и имеет смысл давления, которое имел бы этот газ, занимая весь объём при температуре смеси.
Просуммировав (1.23) по всем компонентам, получим:
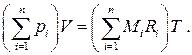 (1.24)
(1.24)
Согласно закону Дальтона, сумма парциальных давлений компонентов смеси идеальных газов равна полному давлению смеси, т.е.
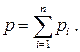 (1.25)
(1.25)
С другой стороны, смесь идеальных газов должна описываться уравнением состояния Менделеева–Клапейрона 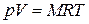 , где под R следует понимать некоторую эффективную, "кажущуюся", газовую постоянную смеси, а масса смеси M равна, очевидно, сумме масс компонентов. Таким образом, (1.24) с учётом закона Дальтона запишется в виде
, где под R следует понимать некоторую эффективную, "кажущуюся", газовую постоянную смеси, а масса смеси M равна, очевидно, сумме масс компонентов. Таким образом, (1.24) с учётом закона Дальтона запишется в виде 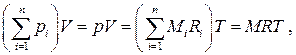 откуда находим
откуда находим
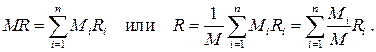
Отношение
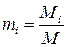 (1.26)
(1.26)
называется массовой долей i –го компонента в смеси, а закон сохранения массы приводит к условию:
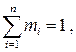 (1.27)
(1.27)
Кажущаяся газовая постоянная смеси с учётом определения массовых долей (1.26) вычисляется следующим образом:
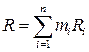 . (1.28)
. (1.28)
Кажущаяся молекулярная масса смеси вычисляется тогда по определению (1.23):
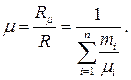 (1.29)
(1.29)
На практике чаще задаётся не массовый состав смеси (1.26), а объёмный, определяемый набором объёмных долей компонентов:
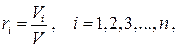 (1.30)
(1.30)
где величины Vi представляют собой так называемые приведённые объёмы. Приведённый объём i –го компонента имеет смысл объёма, который занимал бы этот компонент при давлении и температуре смеси и вычисляется следующим образом:
 (1.31)
(1.31)
Из закона Дальтона следует тогда
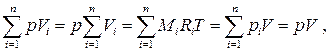 т.е.
т.е. 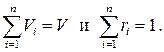 (1.32)
(1.32)
В химии состав смеси часто задаётся так называемыми мольными долями, определяемыми отношениями
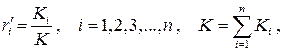 (1.33)
(1.33)
где Ki – число киломолей i –го компонента; K – полное число киломолей смеси. Поскольку, согласно закону Авогадро, одинаковое число киломолей любого идеального газа занимают одинаковый объём, отсюда следует равенство мольных и объёмных долей, т.е.
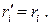 (1.34)
(1.34)
Приведём ещё одно полезное соотношение, следующее из (1.30) и (1.32):
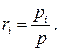 (1.35)
(1.35)
Между массовыми и объёмными долями компонентов в смеси должна существовать однозначная связь. Найдём её, используя определение массовой доли (1.26) и соотношение (1.35):
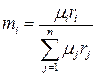 . (1.36)
. (1.36)
Обратная связь находится из определения объёмных (1.30) и массовых долей (1.26):
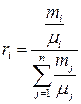 . (1.37)
. (1.37)
Умножив это выражение на μi и просуммировав по i с учётом (1.27) и (1.29), получим полезные соотношения:
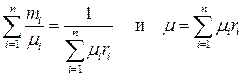 (1.38)
(1.38)
ПЛАН ЛЕКЦИИ:
1. Организационная часть лекции: принимается рапорт о готовности курсантов к занятию, отмечаются в журнале отсутствующие (время 3-5 мин.).
 2014-02-03
2014-02-03 874
874








