Рис.3.
Рис.2.
Классификация свободных радикалов, образующихся в нашем организме
Радикалы кислорода.
Человеку, как и всякому многоклеточному организму, приходиться бороться с микробами, случайно попавшими внутрь его тела в кровь. Эту борьбу ведут специализированные клетки – фагоциты, к которым относятся гранулоциты и моноциты крови и тканевые клетки – макрофаги. Все эти клетки, соприкасаясь с поверхностью клеток бактерий, начинают энергично выделять свободные радикалы в результате переноса электрона от НАДФН-оксидазного ферментного комплекса, встроенного в мембраны фагоцита, на растворенный молекулярный кислород (см. схему на рис. 3).
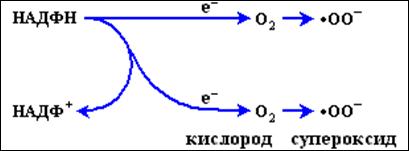
Образование супероксидного радикала фагоцитами
НАДФН + 2O2 -> НАДФ+ + 2O2•- (супероксид анион–радикал)
При этом каждая молекула НАДФН, окисляясь, отдает два электрона в цепь переноса электронов, а каждый из этих электронов присоединяется к молекуле кислорода, в результате чего образуется супероксид – (анион)радикал. Супероксидные радикалы, как мы увидим позже, могут нанести вред как самим фагоцитам, так и другим клеткам крови и, разумеется, микробам, вызвавшим активацию макрофага. Естественно, что все эти клетки стараются избавиться от супероксид-радикалов, для чего они вырабатывают ферменты, называемые супероксиддисмутазами (СОД).Различаясь по строению активного центра и структуре полипептидной цепи, все СОД катализирует одну и ту же реакции дисмутации супероксидного радикала:
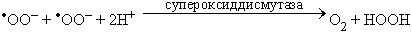
При этом супероксид превращается в кислород и перекись водорода. Судьба последней может быть разной (см. рис. 2 из лекции №5).
В норме фагоциты используют перекись водорода для синтеза гипохлорита, выделяя специальный фермент - миелопероксидазу (МП). Миелопероксидаза катализирует реакцию:

Гипохлорит разрушает стенку бактериальной клетки и тем самым убивает бактерии. Перекись водорода диффундирует в клетки, но там разрушается в результате активности ферментов каталазы и глутатион-пероксидазы (GSH-пероксидазы), которые катализируют, соответственно, такие реакции:

В присутствии ионов двухвалентного железа перекись водорода разлагается с образованием гидроксильного радикала (HO·):
H2O2 + Fe2+ -> Fe3+ + HO- + HO·
Эта реакция (известная как реакция Фентона) приводит к печальным последствиям для окружающих клеток. Радикал гидроксила чрезвычайно активен химически и разрушает почти любую встретившуюся ему молекулу. Действуя на SH-группы, гистидиновые и другие аминокислотные остатки белков, HO· вызывает денатурацию последних и инактивирует ферменты. В нуклеиновых кислотах HO· разрушает углеводные мостики между нуклеотидами и, таким образом, разрывает цепи ДНК и РНК; в результате чего происходят мутации и гибель клеток. Внедряясь в липидный слой клеточных мембран, гидроксильный радикал запускает (инициирует) реакции цепного окисления липидов, что приводит к повреждению мембран, нарушению их функций и гибели клеток. Таким образом, радикал HO· – это радикал-разрушитель, радикал-убийца. Гидроксильный радикал образуется не только в реакции Фентона. А. Н. Осиповым в нашей лаборатории было показано, что гидроксильные радикалы образуются также при взаимодействии ионов железа (Fe2+) с гипохлоритом. При этом радикал гидроксила выделяется даже с более высоким выходом, чем в реакции Фентона.
ClO- + Fe2+ + H+ -> Fe3+ + Cl- + HO·
Возвращаясь к реакциям утилизации перекиси водорода, можно сказать, что первая из них – реакция, полезная для организма человека, вторая и третья – защитные, а две последние – безусловно вредны для окружающих клеток и тканей. Супероксидный радикал и продукты его метаболизма (H2O2, HO·, ·OO-, ClO-) называют активными формами кислорода.
Окись азота
Второй свободный радикал, синтезируемый живыми клетками, – это монооксид азота NO·, часто называемый просто окисью азота. Структурную формулу окиси азота можно записать как ·N=O. NO· образуется клетками стенок кровеносных сосудов (эндотелия); эта реакция катализируется гем-содержащим ферментом NO-синтазой. В присутствии соединений, содержащих SH-группы, из ·NO образуется выделяемый эндотелием "фактор расслабления". Он играет ключевую роль в регуляции тонуса сосудов и кровяного давления: его недостаток приводит к гипертонии, избыток – к гипотонии. Именно с нарушением метаболизма фактора расслабления связывают такие заболевания как эссенциальная гипертензия и другие, связанные с нарушением нормального кровяного давления. ·NO выделяется также клетками-фагоцитами и вместе с супероксид-радикалами используется для борьбы с микробами (преимущественно грибковой природы). Полагают, что цитотоксическое действие NO· обусловлено его реакцией с супероксидом:
•N=O + •O-O- + H+ -> O=N-O-OH (пероксинитрит)
Пероксинитрит, образующийся в этой реакции, может разлагаться с образованием ·OH:
O=N-O-OH -> O=N-O· + HO· (радикал гидроксила)
Образование пероксинитрита и радикала гидроксила приводит к повреждению клеток при взаимодействии ·NO с супероксидом. Хорошо, если повреждающее действие системы (·NO + супероксид) направлено на болезнетворные микроорганизмы. Плохо, если оно направлено на свои собственные клетки и ткани. Поэтому в тех участках кровяного русла, где выделяется ·NO (как необходимый регулятор кровяного давления), не должно быть супероксидных радикалов. Для этого, в частности, в этих местах синтезируется фермент СОД, который удаляет супероксид.
Радикал коэнзима Q
Биологическое окисление субстратов клеточного дыхания, таких как глюкоза, пировиноградная и янтарная кислота и другие, осуществляется, как известно, в два этапа. На первом этапе в цикле трикарбоновых кислот происходит последовательный отрыв атомов водорода от субстрата и образование восстановленных форм пиридиннуклеотидов НАДН и НАДФН. На втором этапе электроны от НАДН и НАДФН переносятся по так называемой дыхательной цепи на кислород. В состав дыхательной цепи входят флавопротеиды, комплексы негемового железа, убихинон и гемопротеиды (цитохромы a,b и c и цитохром-оксидаза). Схема дыхательной цепи дана на рис. 4. Важным звеном цепи переноса электронов служит убихинол (коэнзим Q)(см. рис. 5), радикал которого (семихинон, ·QH) образуется либо при одноэлектронном окислении убихинола (QH2, гидрохинон-форма) (см. рис. 6), либо при одноэлектронном восстановлении убихинона (Q) (см. рис. 7). В норме радикал этот – не более как рядовой участник процесса переноса электронов; но при нарушении работы дыхательной цепи он может стать источником других, менее безобидных радикалов, в первую очередь, радикалов кислорода.
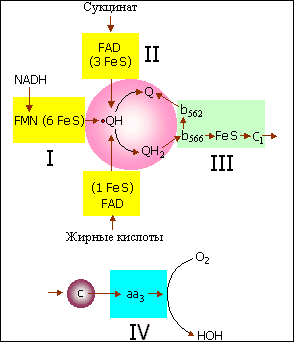
Рис.4.
Дыхательная цепь митохондрий (схема)
Римскими цифрами обозначены дыхательные комплексы, на которые мембраны митохондрий впервые разделил Дэвид Грин. Строчными буквами обозначены цитохромы, остальные сокращения общеприняты в биохимии.
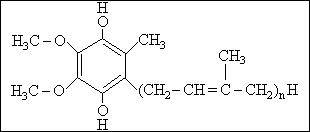
Рис.5.
Убихинол (коэнзим Q)
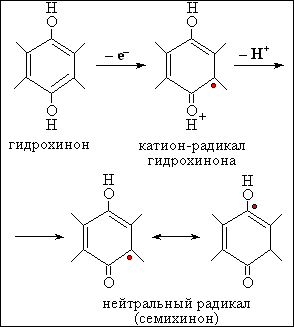
Рис.6.
Образование семихинона при одноэлектронном окислении убихинола
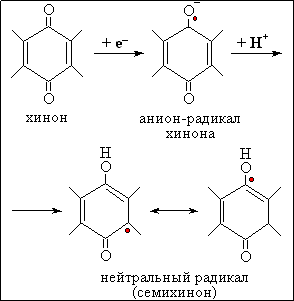
Рис.7.
Образование семихинона при одноэлектронном восстановлении убихинона
Содержание данного раздела почти полностью повторяет соответствующий раздел в лекции №5.
См. также лекцию «Кинетика реакций цепного окисления липидов».
Реакция цепного окисления липидов играет исключительную роль в клеточной патологии, и следует остановиться на ее механизме. Она протекает в несколько стадий, которые получили название инициирование, продолжение, разветвление и обрыв цепи (см. рис. 8 и 9). Рассмотрим эти стадии подробнее. Инициирование цепной реакции начинается с того, что в липидный слой мембран или липопротеинов внедряется свободный радикал. Чаще всего это радикал гидроксила. Будучи небольшой по размеру незаряженной частицей, он способен проникать в толщу гидрофобного липидного слоя и вступать в химическое взаимодействие с полиненасыщенными жирными кислотами (которые принято обозначать как LH), входящими в состав биологических мембран и липопротеинов плазмы крови. При этом образуются липидные радикалы:
HO· + LH -> H2O + L·
Липидный радикал (L·) вступает в реакцию с растворенным в среде молекулярным кислородом; при этом образуется новый свободный радикал – радикал липоперекиси (LOO·):
L· + O2 -> LOO·
Этот радикал атакует одну из соседних молекул фосфолипида с образованием гидроперекиси липида LOOH и нового радикала L·:
LOO· + LH -> LOOH + L·
Чередование двух последних реакций как раз и представляет собой цепную реакцию перекисного окисления липидов (см рис.8).
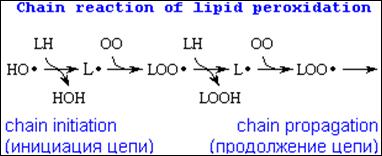
Рис.8. Цепная ракция перекисного окисления
Существенное ускорение пероксидации липидов наблюдается в присутствии небольших количеств ионов двухвалентного железа. В этом случае происходит разветвление цепей в результате взаимодействия Fe2+ c гидроперекисями липидов:
Fe2+ + LOOH -> Fe3+ + HO- + LO·
Образующиеся радикалы LO· инициируют новые цепи окисления липидов (см. рис.9):
LO· + LH -> LOH + L·;
L· + O2 -> LOO· -> и т.д.
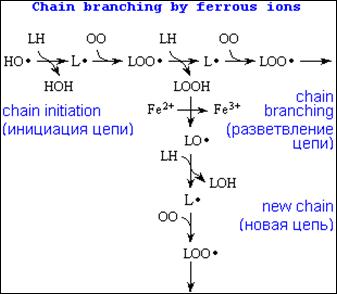
Рис.9. Разветвление цепи перекисного окисления липидов ионами железа
В биологических мембранах цепи могут состоять из десятка и более звеньев. Но в конце концов цепь обрывается в результате взаимодействия свободных радикалов с антиоксидантами (InH), ионами металлов переменной валентности (например, теми же Fe2+) или друг с другом:
LOO· + Fe2+ + H+ -> LOOH + Fe3+
LOO· + InH -> In· + LOOH
LOO· + LOO· -> молекулярные продукты + фотон
Последняя реакция особенно интересна, поскольку она сопровождается свечением (хемилюминесценцией). Интенсивность этой хемилюминесценции очень мала, поэтому ее иногда называют "сверхслабым свечением". Интенсивность свечения пропорциональна квадрату концентрации свободных радикалов в мембранах, а скорость перекисного окисления прямо пропорциональна концентрации тех же радикалов. Поэтому интенсивность "сверхслабого" свечения однозначно отражает скорость липидной пероксидации в изучаемом биологическом материале, и измерение хемилюминесценции довольно часто используется при изучении перекисного окисления липидов в различных объектах.
См. также раздел «Хемилюминесценция как метод изучения реакций, идущих с участием свободных радикалов» в лекции №5 и лекцию №9.
 2014-02-03
2014-02-03 7870
7870
