Протамины
Гистоны
Глобулины
Альбумины
Группа белков с молекулярной массой около 40 кД, имеют кислые свойства и отрицательный заряд при физиологических рН, т.к. содержат много глутаминовой кислоты. Легко адсорбируют полярные и неполярные молекулы, является в крови переносчиком многих веществ
Группа разнообразных белков с молекулярной массой до 100 кД, слабокислые или нейтральные, поэтому они слабо гидратированы, менее устойчивы и легче осаждаются, что используется в клинической диагностике в „осадочных" пробах (тимоловая, Вельтмана). Часто содержат углеводные компоненты.
При электрофорезе разделяются, как минимум, на 4 фракции – a1, a2, b и g.
Функция:
Часть альфа-глобулинов обладает антипротеазной активностью, что защищает белки крови от преждевременного разрушения. Гамма-глобулины являются антителами и обеспечивают иммунную защиту организма.
Некоторые глобулины способны к связыванию определенных веществ: трансферрин (переносчик Fe), церулоплазмин (переносчик Си), гаптоглобин (переносчик гемоглобина), гемопексин (переносчик тема).
Белки массой около 24 кД. Обладают выраженными основными свойствами, поэтому при физиологических рН заряжены положительно и связываются с дезоксирибонуклеиновой кислотой (ДНК). Существуют 5 типов гистонов:
Н1 – очень богат Лиз (29%),
Н2а – умеренно богат Лиз (11%) и Apr (9,5%),
H2b – умеренно богат Лиз (16%) и Apr (6,5%),
НЗ – умеренно богат Лиз (10%) и Apr (13,5%),
Н4 – умеренно богат Лиз (11%) и Apr (14%).
Радикалы аминокислот в составе гистонов могут быть ферментативно метилированы, ацетилированы или фосфорилированы. Это изменяет суммарный заряд и другие свойства белков.
Функция:
1. Регулируют активность генома, а именно – препятствуют транскрипции,
2. Структурная – стабилизируют пространственную структуру ДНК.
Это белки массой от 4 кД до 12 кД, у ряда организмов они являются заменителями гистонов, есть в спермиях. Отличаются резко увеличенным содержанием аргинина (до 80%). Функция – структурная.
Фибриллярный белок с уникальной структурой. Обычно содержит моносахаридные (галактоза) и дисахаридные (галактоза-глюкоза) остатки, соединенные с ОН-группами некоторых остатков гидроксилизина. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях.
Полипептидная цепь коллагена включает 1000 аминокислот и состоит из повторяющегося триплета [Гли-А-В], где А и В – любые, кроме глицина аминокислоты. В основном это аланин, его доля составляет 11%, доля пролина и гидроксипролина – 21%. Таким образом, на другие аминокислоты приходится всего 33%. Структура пролина и гидроксипролина не позволяет образовать a-спиральную структуру, из-за этого образуется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка.
Дополнение
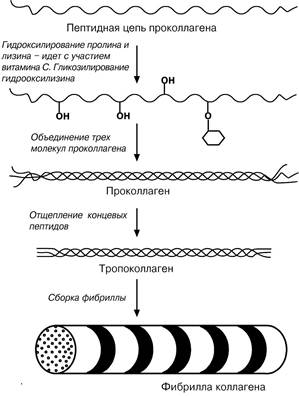 Гидроксилирование пролина осуществляет фермент пролилгидроксилаза, железо-содержащий фермент, для его полноценной работы необходим витамин С (аскорбиновая кислота). Недостаточность аскорбиновой кислоты в пище обуславливает возникновение цинги. Приматы и морские свинки утратили способность синтезировать аскорбиновую кислоту и, поэтому, должны получать ее с пищей. Являясь сильным восстановительным агентом, аскорбиновая кислота предохраняет от инактивации пролилгидроксилазу, поддерживая восстановленное состояние атома железа в ферменте. Коллаген, синтезированный в отсутствие аскорбиновой кислоты, оказывается недогидроксилированным и не может образовывать нормальные по структуре волокна, что приводит к поражению кожи и ломкости сосудов.
Гидроксилирование пролина осуществляет фермент пролилгидроксилаза, железо-содержащий фермент, для его полноценной работы необходим витамин С (аскорбиновая кислота). Недостаточность аскорбиновой кислоты в пище обуславливает возникновение цинги. Приматы и морские свинки утратили способность синтезировать аскорбиновую кислоту и, поэтому, должны получать ее с пищей. Являясь сильным восстановительным агентом, аскорбиновая кислота предохраняет от инактивации пролилгидроксилазу, поддерживая восстановленное состояние атома железа в ферменте. Коллаген, синтезированный в отсутствие аскорбиновой кислоты, оказывается недогидроксилированным и не может образовывать нормальные по структуре волокна, что приводит к поражению кожи и ломкости сосудов.
Молекула коллагена построена из 3 полипептидных цепей, сплетенных между собой в плотный жгут – тропоколлагена (длина=ЗОО нм, d=1,6 нм). Полипептидные цепи прочно связаны между собой через e-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы (d=10-300 нм). Фибриллы очень прочны, они прочнее стальной проволоки равного сечения. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины.
В коже фибриллы образуют нерегулярно сплетенную и очень густую сеть – выделанная кожа представляет собой почти чистый коллаген.
Дополнение
Время полужизни коллагена исчисляется неделями и месяцами. Ключевую роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на 1/4 расстояния с С-конца между Гли и Лей.
В результате распада коллагена образуется гидроксипролин. При поражении соединительной ткани (болезнь Пейджета, гиперпаратиреоидизм) экскреция гидроксипролина возрастает и имеет диагностическое значение. По мере старения организма в тропоколлагене образуется все большее число поперечных связей, что делает фибриллы коллагена в соединительной ткани более жесткими и хрупкими. Это ведет к повышенной ломкости кости и снижению прозрачности роговицы глаза в старческом возрасте.
 2014-02-03
2014-02-03 1371
1371
